Активни съставки: суматриптан (суматриптан сукцинат)
IMIGRAN 6 mg / 0,5 ml инжекционен разтвор за подкожно приложение
ИМИГРАН 50 mg филмирани таблетки
ИМИГРАН 100 mg филмирани таблетки
Предлагат се опаковъчни вложки на Imigran за опаковки: - IMIGRAN 6 mg / 0,5 ml инжекционен разтвор за подкожна употреба, IMIGRAN 50 mg филмирани таблетки, IMIGRAN 100 mg филмирани таблетки
- Imigran 25 mg супозитории
- Imigran 10 mg и 20 mg спрей за нос
Показания Защо Imigran се използва? За какво е?
ФАРМАКОТЕРАПЕВТИЧНА КАТЕГОРИЯ
Селективни агонисти на 5-НТ1 рецептор срещу мигрена
ТЕРАПЕВТИЧНИ ПОКАЗАНИЯ
IMIGRAN инжекционни и таблетки са показани за лечение на остра мигренозна атака със или без аура, включително остри пристъпи на мигрена, свързани с менструалния период.ИМИГРАН ИНЖЕКЦИЯ е показан и за лечение на клъстерно главоболие.
Противопоказания Когато Imigran не трябва да се използва
Свръхчувствителност към активното вещество или към някое от помощните вещества.
Суматриптан не трябва да се използва при пациенти, които са имали инфаркт на миокарда или имат исхемична болест на сърцето, коронарен вазоспазъм (стенокардия на Prinzmetal), периферно съдово заболяване или с признаци или симптоми, свързани с исхемична болест на сърцето.
Суматриптан не трябва да се дава на пациенти с анамнеза за мозъчно -съдов инцидент (CVA) или преходна исхемична атака (TIA).
Суматриптан не трябва да се прилага при пациенти с тежко чернодробно увреждане. Употребата на суматриптан е противопоказана при пациенти с умерена и тежка хипертония и лека неконтролирана хипертония.
Едновременното приложение на ерготамин или ерготаминови производни (включително метисергид) или който и да е агонист на триптан / 5-хидрокситриптамин1 (5-НТ1) рецептор е противопоказано (вж. Точка "Взаимодействия").
Едновременното приложение на инхибитори на моноаминооксидазата (MAOI) и суматриптан е противопоказано.
Суматриптан не трябва да се използва в рамките на две седмици след спиране на лечението с инхибитор на моноаминооксидазата.
Предпазни мерки при употреба Какво трябва да знаете, преди да приемете Imigran
Филмирани таблетки
Суматриптан трябва да се използва само след ясна диагноза мигрена.
Инжекционен разтвор за подкожна употреба
Суматриптан трябва да се използва само след ясна диагноза на мигрена или клъстерно главоболие. Инжекционният разтвор на суматриптан не трябва да се използва интравенозно.
Всички фармацевтични форми
Употребата на суматриптан не е показана при лечение на хемиплегична, базиларна или офталмоплегична мигрена. Преди започване на лечението със суматриптан трябва да се внимава да се изключат потенциално сериозни неврологични състояния (напр. Мозъчно -съдови инциденти (CVA), преходни исхемични атаки (TIA)), ако пациентите имат атипични симптоми или ако не са имали подходяща диагноза. Използване на суматриптан.
Приложението на суматриптан може да бъде придружено от преходни симптоми, включително болка в гърдите и стягане, които могат да бъдат интензивни и да засегнат гърлото (вж. Точка "Нежелани реакции"). Ако се смята, че такива симптоми са показателни за исхемична болест на сърцето, не трябва да се дават допълнителни дози суматриптан и да се прави подходяща оценка. при пациенти се наблюдава съдова резистентност (вж. точка "Противопоказания").
Има редки постмаркетингови съобщения за пациенти със серотонинов синдром (който включва променен психичен статус, автономна нестабилност и невромускулни аномалии) след употреба на селективен инхибитор на обратното захващане на серотонин (SSRI) и суматриптан. Съобщава се за серотонинов синдром след едновременно лечение с триптани и инхибитори на обратното захващане на серотонин и норепинефрин (SNRIs).
Ако едновременното лечение на суматриптан със SSRI / SNRI е клинично оправдано, се препоръчва "подходящо наблюдение на пациента" (вж. Точка "Взаимодействия").
Суматриптан трябва да се прилага с повишено внимание при пациенти със състояния, които могат значително да променят абсорбцията, метаболизма и екскрецията на лекарството, като например в случай на чернодробна (степен А или В по Child Pugh) или бъбречна недостатъчност.
Суматриптан трябва да се използва с повишено внимание при пациенти с епилепсия и / или в анамнеза за гърчове или други рискови фактори, които понижават праговото ниво на гърчовете, тъй като са съобщени гърчове във връзка със суматриптан (вж. Точка "Нежелани реакции").
Пациентите с известна свръхчувствителност към сулфонамиди могат да проявят алергична реакция след прилагане на суматриптан. Реакциите могат да варират от кожна свръхчувствителност до „анафилаксия“. Доказателствата за кръстосана реактивност са ограничени, но трябва да се внимава преди употребата на суматриптан при тези пациенти.
Нежеланите реакции могат да се появят по -често при едновременната употреба на триптани и препарати на базата на жълт кантарион (Hypericum perforatum).
Продължителната употреба на всякакъв вид обезболяващо средство при главоболие може да го влоши. Ако това се случи или се подозира, трябва да се потърси лекарска помощ и лечението да се прекрати.
Диагноза главоболие от прекомерна употреба на лекарства за главоболие трябва да се подозира при пациенти, които имат чести или ежедневни главоболия въпреки (или поради) редовната употреба на лекарства за главоболие.
Суматриптан не трябва да се дава на пациенти с рискови фактори за исхемична болест на сърцето, включително тези пациенти, които са тежки пушачи или използват заместващи никотин терапии, без първо да се направи сърдечно -съдова оценка (вж. Точка "Противопоказания"). Особено внимание трябва да се обърне на жени и мъже в постменопауза на възраст над 40 години, при които тези рискови фактори са налице. Тези оценки обаче може да не идентифицират всеки пациент със сърдечно заболяване и в много редки случаи са настъпили сериозни сърдечни събития при пациенти без основно сърдечно -съдово заболяване.
Взаимодействия Кои лекарства или храни могат да променят ефекта на Imigran
Уведомете Вашия лекар или фармацевт, ако наскоро сте приемали други лекарства, дори и такива без рецепта
Няма данни за взаимодействия с пропранолол, флунаризин, пизотифен или алкохол.
Препаратите, съдържащи ерготамин или други триптани / 5-НТ1 рецепторни агонисти, могат да предизвикат продължителни вазоспастични реакции. Данните, свързани с взаимодействията с тези лекарства, са ограничени. Съществува теоретична възможност за повишен риск от коронарен вазоспазъм, поради което едновременното приложение е противопоказано (вж. Точка "Противопоказания").
Не е известен периодът от време между употребата на суматриптан и препарати, съдържащи ерготамин или други триптани / 5-НТ1 рецепторни агонисти. Това също ще зависи от дозите и видовете използвани продукти. Ефектите могат да бъдат пристрастяващи. Да. се препоръчва да се изчака поне 24 часа след използване на препарати, съдържащи ерготамин или други триптани / 5-НТ1 рецепторни агонисти, преди да се приложи суматриптан. Обратно, препоръчително е да се изчака най-малко шест часа след употребата на суматриптан, преди да се приложи продукт, съдържащ ерготамин, и най-малко 24 часа преди да се приложи друг агонист на триптан / 5-НТ1 рецептор.
Може да възникне "взаимодействие между суматриптан и МАО -инхибитори и едновременното приложение е противопоказано (вижте раздел" Противопоказания ").
Има редки постмаркетингови съобщения за пациенти със серотонинов синдром (който включва променен психичен статус, автономна нестабилност и невромускулни аномалии) след употребата на селективен инхибитор на обратното захващане на серотонин (SSRI) и суматриптан. Съобщава се също за серотонинов синдром след едновременно лечение с триптани и селективни инхибитори на обратното захващане на норепинефрин (вж. точка "Предпазни мерки при употреба").
Предупреждения Важно е да знаете, че:
Бременност и кърмене
Посъветвайте се с Вашия лекар или фармацевт, преди да приемете каквото и да е лекарство.
Бременност
Има постмаркетингови данни за употребата на суматриптан през първия триместър на бременността при над 1000 жени. Въпреки че тези данни не съдържат достатъчно информация, за да се направят твърди заключения, те не разкриват увеличаване на риска от вродени дефекти.
Опитът с употребата на суматриптан през втория и третия триместър е ограничен.
Експерименталните проучвания върху животни не показват тератогенни или опасни ефекти в пери- или постнаталното развитие. Въпреки това, ембрионалната и феталната смърт може да настъпи при заека. Прилагането на суматриптан трябва да се има предвид само ако ползата за майката е по -голяма от възможния риск за плода.
Време за хранене
След подкожно приложение е показано, че суматриптан се екскретира в кърмата.Излагането на кърмачета на лекарството може да бъде сведено до минимум, като се избягва кърменето през 12 -те часа след лечението, през което време количеството произведено кърма трябва да се елиминира.
Ефекти върху способността за шофиране и работа с машини
Не са провеждани проучвания за способността за шофиране или работа с машини.
Лечението с мигрена или суматриптан може да причини сънливост.Това може да повлияе на способността за шофиране или работа с машини.
Препоръчва се повишено внимание при пациенти, извършващи такива дейности.
Важна информация за някои от съставките
IMIGRAN съдържа по-малко от 1 mmol (23 mg) натрий на доза, т.е. по същество "без натрий".
Дозировка и начин на употреба Как да използвате Imigran: Дозировка
Всички фармацевтични форми
Суматриптан не трябва да се използва за профилактика.
Препоръчителната доза суматриптан не трябва да се превишава.
Филмирани таблетки
Суматриптан се препоръчва като монотерапия за лечение на остра мигренозна атака и не трябва да се прилага едновременно с ерготамин или ерготаминови производни (включително метисергид) (вж. Точка "Противопоказания").
Препоръчва се суматриптан да се приема възможно най -скоро след началото на мигренозния пристъп. Лекарството е еднакво ефективно, когато се приема по време на пристъпа.
Инжекционен разтвор за подкожна употреба
Препоръчва се суматриптан да се приема възможно най -скоро след началото на мигренозния пристъп или свързаните с него симптоми като гадене, повръщане или фотофобия. Лекарството е еднакво ефективно, когато се приема по време на пристъпа.
Ефикасността на суматриптан не зависи от времето, изминало между началото на атаката и началото на лечението.
Приложението по време на фазата на аурата преди появата на други симптоми може да не предотврати появата на главоболие.
Населения
Филмирани таблетки
- Възрастни
Препоръчителната доза перорален суматриптан е една таблетка от 50 mg. Някои пациенти може да се нуждаят от 25 mg или 100 mg.
Ако пациентът не реагира на първата доза суматриптан, не трябва да се приема втора доза за същата атака. В тези случаи атаката може да бъде лекувана с парацетамол, ацетилсалицилова киселина или нестероидни противовъзпалителни средства. Суматриптан таблетки могат да се приемат за последващи атаки. Ако пациентът е отговорил на първата доза, но симптомите се повтарят, може да се използва втора доза трябва да се прилага, докато има интервал от поне 2 часа между двете дози. Не трябва да се приемат повече от 300 mg за всеки 24 -часов период.
Таблетките трябва да се поглъщат цели с вода. Пациентите със затруднено преглъщане могат да изберат да разпръснат суматриптановата таблетка в малко количество вода преди прием.Таблетките суматриптан, разпръснати във вода, имат горчив вкус.
- Педиатрична популация
Ефикасността и безопасността на таблетките суматриптан (филмирани) при деца на възраст под 10 години не са установени. Няма клинични данни за тази възрастова група.
Ефикасността и безопасността на таблетките суматриптан (филмирани) при деца и юноши на възраст от 10 до 17 години не са доказани в клинични проучвания, проведени в тази възрастова група. до 17 -годишна възраст не се препоръчва.
- Възрастни хора (над 65 години)
Има ограничен опит с употребата на суматриптан таблетки при пациенти на възраст над 65 години. Фармакокинетиката не се различава значително от тази при по -младата популация, но докато не се получат допълнителни клинични данни, употребата на таблетки суматриптан при пациенти над 65 години не се препоръчва.
Инжекционен разтвор за подкожна употреба
Суматриптан за инжектиране трябва да се прилага подкожно с помощта на автоинжектора.
Пациентите трябва да бъдат посъветвани да спазват стриктно инструкциите за употреба на автоинжектора на суматриптан, особено по отношение на безопасното изхвърляне на спринцовки и игли.
- Възрастни
Мигрена
Препоръчителната доза инжекционен разтвор на суматриптан е единична подкожна инжекция от 6 mg. Ако пациентът не реагира на първата доза суматриптан, не може да се приеме втора доза за същата атака. В тези случаи атаката може да бъде лекувана с парацетамол, ацетилсалицилова киселина или нестероидни противовъзпалителни средства. Суматриптанов инжекционен разтвор може да се приема за последващи атаки. Ако пациентът е отговорил на първата доза, но симптомите се повтарят, може да се направи втора доза да се приема през следващите 24 часа, при условие че има минимален интервал от един час между двете дози.
Максималната доза за 24 часа е две инжекции от 6 mg (12 mg).
Клъстерно главоболие
Препоръчителната доза инжекционен разтвор на суматриптан е единична подкожна инжекция от 6 mg за всеки пристъп на главоболие. Максималната доза за 24 часа е две инжекции от 6 mg (12 mg), с минимален интервал от един "час между двете дози.
- Деца и юноши (под 18 години)
Употребата на суматриптан инжекционен разтвор не се препоръчва при деца и юноши поради недостатъчни данни за безопасността и ефикасността.
- Възрастни хора (над 65 години)
Има ограничен опит с употребата на суматриптан при пациенти на възраст над 65 години. Фармакокинетиката не се различава значително от тази на по -младата популация, но докато не се получат допълнителни клинични данни, употребата на суматриптан при пациенти над 65 години не се препоръчва.
Инструкции за употреба
Следвайте инструкциите в края на листовката.
Предозиране Какво да направите, ако сте приели твърде много Imigran
Симптоми и признаци
Филмирани таблетки
Дозите до 100 mg през устата не са свързани с други странични ефекти, освен посочените по -долу.
Инжекционен разтвор за подкожна употреба
Пациентите са получавали единични подкожни инжекции до 12 mg без значителни нежелани реакции. Дозите до 16 mg подкожно не са свързани с други странични ефекти, освен изброените по -долу.
Лечение
Всички фармацевтични форми В случай на предозиране пациентът трябва да бъде проследяван най -малко десет часа и при необходимост да се започне подходяща поддържаща грижа. Ефектите от хемодиализата или перитонеалната диализа върху плазмените концентрации на суматриптан са неизвестни.
В случай на случайно поглъщане / прием на прекомерна доза IMIGRAN, незабавно уведомете Вашия лекар или отидете в най -близката болница.
Ако имате въпроси относно употребата на IMIGRAN, попитайте Вашия лекар или фармацевт.
Странични ефекти Какви са страничните ефекти на Imigran
Както всички лекарства, IMIGRAN може да предизвика нежелани реакции, въпреки че не всеки ги получава.
Нежеланите реакции са изброени по -долу по системо -органни класове и честота. Честотите се определят като: много чести (> 1/10), общи (> 1/100 до 1/1 000 до 1/10 000 до
Всички фармацевтични форми
Нарушения на имунната система
С неизвестна честота: реакции на свръхчувствителност, които могат да варират от кожна свръхчувствителност (като копривна треска) до анафилаксия.
Нарушения на нервната система
Чести: замаяност, сънливост, сензорни нарушения, включително парестезия и хипоестезия.
С неизвестна честота: гърчове, въпреки че някои от тези случаи са настъпили при пациенти с анамнеза за гърчове или съпътстващи състояния, предразполагащи към гърчове. Има съобщения и при пациенти, за които такива предразполагащи фактори не са очевидни. Тремор, дистония, нистагъм, скотома.
Очни нарушения
С неизвестна честота: трептене на зрението, диплопия, нарушено зрение. Загуба на зрение, включително случаи на трайни дефекти. Очни нарушения обаче могат да възникнат и по време на самата мигренозна атака.
Сърдечни патологии
С неизвестна честота: брадикардия, тахикардия, сърцебиене, сърдечни аритмии, преходни исхемични промени на ЕКГ, коронарен вазоспазъм, стенокардия, миокарден инфаркт (вж. Раздели "Противопоказания", "Предпазни мерки при употреба" и "Взаимодействия").
Съдови патологии
Чести: преходно повишаване на кръвното налягане, настъпило скоро след приложението. Зачервяване.
С неизвестна честота: хипотония, феномен на Рейно.
Дихателни, гръдни и медиастинални нарушения
Чести: диспнея.
Стомашно -чревни нарушения
Чести: При някои пациенти се съобщава за гадене и повръщане, но не е ясно дали това е свързано със суматриптан или съществуващи състояния.
С неизвестна честота: исхемичен колит. С неизвестна честота: диария.
Нарушения на мускулно -скелетната система и съединителната тъкан
Чести: усещане за тежест (обикновено преходно, може да бъде интензивно и може да засегне всяка част на тялото, включително гърдите и гърлото). Миалгия.
С неизвестна честота: скованост на шията.
С неизвестна честота: артралгия.
Общи нарушения и състояния на мястото на приложение
Чести: болка, усещане за топлина или студ, натиск или стягане (тези събития обикновено са преходни, могат да бъдат интензивни и могат да засегнат всяка част на тялото, включително гърдите и гърлото); чувство на слабост, умора (и двете събития са до голяма степен леки до умерени по интензивност и преходни).
Диагностични тестове
Много редки: Понякога са наблюдавани леки промени в чернодробните функционални тестове.
Психични разстройства
С неизвестна честота: тревожност.
Нарушения на кожата и подкожната тъкан
С неизвестна честота: хиперхидроза.
Само инжекционен разтвор за подкожна употреба
Най -честите нежелани реакции, свързани с подкожно лечение със суматриптан, са:
Общи нарушения и състояния на мястото на приложение
Много чести: преходна болка на мястото на инжектиране.
Много чести: На мястото на инжектиране са докладвани също усещане за парене, оток, еритем, екхимоза и кървене.
Въпреки че няма налични данни за директно сравнение, зачервяването, парестезията, топлината, усещането за натиск и тежестта могат да бъдат по -чести след прилагане на инжекционен суматриптан. Обратно, гаденето, повръщането, умората изглеждат по -рядко след прилагане на инжекционен суматриптан от таблетките.
Спазването на инструкциите, съдържащи се в листовката, намалява риска от нежелани ефекти.
Ако някоя от нежеланите реакции стане сериозна или забележите други, неописани в тази листовка нежелани реакции, моля информирайте Вашия лекар или фармацевт.
Ако получите някакви нежелани реакции, включително всички възможни, неописани в тази листовка нежелани реакции, свържете се с Вашия лекар или фармацевт. Страничните ефекти могат също да бъдат докладвани директно чрез националната система за докладване на адрес https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.С докладването на нежелани реакции можете да помогнете да предоставите повече информация за безопасността на това лекарство.
Срок на годност и задържане
Срок на годност: вижте срока на годност, отбелязан върху опаковката.
Срокът на годност се отнася за продукта в непокътната опаковка, правилно съхраняван. Внимание: не използвайте лекарството след срока на годност, отбелязан върху опаковката.
Правила за опазване
Филмирани таблетки: съхранявайте при температура не по-висока от 30 ° C. Предварително напълнени спринцовки: съхранявайте в оригиналната опаковка, за да предпазите продукта от светлина.
Лекарствата не трябва да се изхвърлят чрез отпадъчни води или битови отпадъци. Попитайте Вашия фармацевт как да изхвърлите лекарствата, които вече не използвате. Това ще помогне за опазването на околната среда.
Съхранявайте това лекарство на място, недостъпно за деца.
СЪСТАВ
IMIGRAN 6 mg / 0,5 ml инжекционен разтвор за подкожно приложение
Всяка предварително напълнена спринцовка съдържа:
Активен принцип:
суматриптан сукцинат 8,4 mg
равно на суматриптан 6 mg.
Помощни вещества: натриев хлорид, вода за инжекции.
Предварително напълнените спринцовки съдържат 6 mg суматриптанова основа като сукцинатна сол в изотоничен разтвор (общ обем: 0,5 ml). Предварително напълнените спринцовки се предлагат с автоинжектор PENKIT.
ИМИГРАН 100 mg филмирани таблетки
Всяка филмирана таблетка съдържа:
Активен принцип:
суматриптан сукцинат 140,0 mg
равно на суматриптан 100 mg.
Помощни вещества: безводен двуосновен калциев фосфат, микрокристална целулоза, натриев бикарбонат, кроскармелоза натрий, магнезиев стеарат, хипромелоза, титанов диоксид (Е 171), глицерол триацетат.
ИМИГРАН 50 mg филмирани таблетки
Всяка филмирана таблетка съдържа:
Активен принцип:
суматриптан сукцинат 70,0 mg
равно на суматриптан 50 mg
Помощни вещества: безводен двуосновен калциев фосфат, микрокристална целулоза, натриев бикарбонат, кроскармелоза натрий, магнезиев стеарат, хипромелоза, титанов диоксид (Е 171), глицеролов триацетат, червен железен оксид (Е 172).
ЛЕКАРСТВЕНА ФОРМА И СЪДЪРЖАНИЕ
Инжекционен разтвор за подкожна употреба:
- 2 предварително напълнени спринцовки от 6 mg с автоинжектор PENKIT.
Филмирани таблетки:
- 100 mg филмирани таблетки
- 4 филмирани таблетки по 50 mg
МЕТОД НА ИЗПОЛЗВАНЕ НА САМОИНЖЕКТОРА PENKIT
Прочетете внимателно и стриктно следвайте инструкциите.
Описание на частите
Автоинжекторът PENKIT съдържа пружинен механизъм за автоматично инжектиране на лекарството и трябва да се използва само след зареждане със спринцовка.
1 - автоинжектор PENKIT
2 - Калъф
3 - Контейнер за спринцовка
A - Син бутон
B - Бяло бутало
C - Сив участък
D - Синя секция
Как да използвате автоинжектора PENKIT
Отворете торбичката Извадете уплътнението от един от двата контейнера за спринцовка.
Забележка: отстранената пломба показва, че тази доза е използвана.
Отворете капачката на контейнера на спринцовката, като я повдигнете.
Извадете автоинжектора PENKIT от кутията, като внимавате да не натиснете синия бутон.
Моля, обърнете внимание: пружинният механизъм в автоинжектора PENKIT е зареден, готов за употреба веднага след изваждането му от кутията, така че бялото бутало не трябва да излиза от долния ръб на автоинжектора PENKIT.
За да заредите автоинжектора PENKIT, поставете го в контейнера за спринцовка и завийте по посока на часовниковата стрелка (приблизително половин оборот).
NB: също по време на тази операция внимавайте да не натиснете бутона, за да не освободите пружинния механизъм, разположен вътре в автоинжектора PENKIT.
Извадете заредения автоинжектор PENKIT, като го държите в права линия.
Устройството е оборудвано с предпазно устройство за предотвратяване на случайни инжекции.
Всъщност автоинжекторът PENKIT работи само когато сивата секция се плъзне към синята част, като по този начин се изключва предпазното устройство (позиция В на снимката).
A - При натискане на синия бутон устройството не работи.
B - С натискане на синия бутон устройството работи.
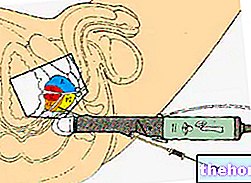
За да поставите инжекцията, натиснете заредения автоинжектор PENKIT към кожата, за предпочитане към външната част на бедрото (вижте илюстрацията), докато сивата част се плъзне по синята част; като държите здраво автоинжектора PENKIT, натиснете силно синия бутон, докато чуете щракване, като държите писалката неподвижна поне 5 секунди.
След 5 секунди отстранете внимателно автоинжектора PENKIT, без да го огъвате, като обърнете внимание на иглата, която излиза.
Незабавно върнете използваната спринцовка в празния й контейнер, като натиснете автоинжектора PENKIT докрай в контейнера. След това развийте автоинжектора PENKIT обратно на часовниковата стрелка (приблизително половин оборот), докато използваната спринцовка остане в контейнера.
С отстранения празен автоинжектор PENKIT, затворете капака на контейнера върху използваната спринцовка.
Забележка: след като устройството е използвано, бялото бутало ще излезе от долния ръб на автоинжектора PENKIT.
Поставете автоинжектора PENKIT обратно в кутията и го натиснете надолу, докато спре с щракване в правилната позиция (внимавайте отново да не натиснете синия бутон).
Забележка: Тази операция позволява натоварването на пружинния механизъм вътре в автоинжектора PENKIT за следващото инжектиране (бялото бутало ще се върне обратно в автоинжектора PENKIT).
Капакът на кутията не може да се затвори, ако пружината не е навита.
След употреба не изхвърляйте празни контейнери в околната среда.
Иглите и спринцовките могат да бъдат опасни и трябва да се изхвърлят правилно и безопасно.
Източник на листовката: AIFA (Италианска агенция по лекарствата). Съдържание, публикувано през януари 2016 г. Наличната информация може да не е актуална.
За да имате достъп до най-актуалната версия, препоръчително е да получите достъп до уебсайта на AIFA (Италианска агенция по лекарствата). Отказ от отговорност и полезна информация.
01.0 ИМЕ НА ЛЕКАРСТВЕНИЯ ПРОДУКТ
ИМИГРАН
02.0 КАЧЕСТВЕН И КОЛИЧЕСТВЕН СЪСТАВ
IMIGRAN 6 mg / 0,5 ml инжекционен разтвор за подкожно приложение
Всяка предварително напълнена спринцовка съдържа:
Активен принцип:
суматриптан сукцинат 8,4 mg
равно на суматриптан 6 mg
ИМИГРАН 100 mg филмирани таблетки
Всяка филмирана таблетка съдържа:
Активен принцип:
суматриптан сукцинат 140,0 mg
равен на суматриптан 100 mg
ИМИГРАН 50 mg филмирани таблетки
Всяка филмирана таблетка съдържа:
Активен принцип:
суматриптан сукцинат 70,0 mg
равно на суматриптан 50 mg
За пълния списък на помощните вещества вижте точка 6.1.
03.0 ЛЕКАРСТВЕНА ФОРМА
- инжекционен разтвор за подкожно приложение;
- филмирани таблетки.
04.0 КЛИНИЧНА ИНФОРМАЦИЯ
04.1 Терапевтични показания
IMIGRAN инжекционни и таблетки са показани за лечение на остра мигренозна атака със или без аура, включително остри пристъпи на мигрена, свързани с менструалния период.
Инжекционният IMIGRAN е показан също за лечение на клъстерно главоболие.
04.2 Дозировка и начин на приложение
Всички фармацевтични форми
Суматриптан не трябва да се използва за профилактика.
Филмирани таблетки
Суматриптан се препоръчва като монотерапия за лечение на остра мигренозна атака и не трябва да се прилага едновременно с ерготамин или ерготаминови производни (включително метисергид) (вж. Точка 4.3).
Препоръчва се суматриптан да се приема възможно най -скоро след началото на мигренозния пристъп. Лекарството е еднакво ефективно, когато се приема по време на пристъпа.
Инжекционен разтвор за подкожна употреба
Препоръчва се суматриптан да се приема възможно най -скоро след началото на мигренозния пристъп или свързаните с него симптоми като гадене, повръщане или фотофобия. Лекарството е еднакво ефективно, когато се приема по време на пристъпа.
Ефикасността на суматриптан не зависи от времето, изминало между началото на атаката и началото на лечението.
Приложението по време на фазата на аурата преди появата на други симптоми може да не предотврати появата на главоболие.
Населения
Филмирани таблетки
§ Възрастни
Препоръчителната доза перорален суматриптан е единична таблетка от 50 mg. Някои пациенти може да се нуждаят от 100 mg.
Ако пациентът не реагира на първата доза суматриптан, не трябва да се приема втора доза за същата атака. В тези случаи атаката може да се лекува с парацетамол, ацетилсалицилова киселина или нестероидни противовъзпалителни средства.Суматриптан таблетки могат да се приемат за последващи атаки.
Ако пациентът е реагирал на първата доза, но симптомите се повтарят, може да се даде втора доза през следващите 24 часа, при условие че има интервал от поне 2 часа между двете дози. Не трябва да се приемат повече от 300 mg по време на 24 часа.
Таблетките трябва да се поглъщат цели с вода. Пациентите със затруднено преглъщане могат да изберат да разпръснат суматриптановата таблетка в малко количество вода преди прием.Таблетките суматриптан, разпръснати във вода, имат горчив вкус.
§ Педиатрична популация
Ефикасността и безопасността на таблетките суматриптан (филмирани) при деца на възраст под 10 години не са установени. Няма клинични данни за тази възрастова група.
Ефикасността и безопасността на таблетките суматриптан (филмирани) при деца и юноши на възраст от 10 до 17 години не са доказани в клинични проучвания, проведени в тази възрастова група. до 17 -годишна възраст не се препоръчва (вж. точка 5.1).
§ Възрастни хора (над 65 години)
Има ограничен опит с употребата на суматриптан таблетки при пациенти на възраст над 65 години. Фармакокинетиката не се различава значително от тази при по -младата популация, но докато не се получат допълнителни клинични данни, употребата на таблетки суматриптан при пациенти над 65 години не се препоръчва.
Инжекционен разтвор за подкожна употреба
Суматриптан за инжектиране трябва да се прилага подкожно с помощта на автоинжектора.
Пациентите трябва да бъдат посъветвани да спазват стриктно инструкциите за употреба на автоинжектора на суматриптан, особено по отношение на безопасното изхвърляне на спринцовки и игли.
§ Възрастни
МИГРЕЙН
Препоръчителната доза суматриптан за инжектиране е единична подкожна инжекция от 6 mg.
Ако пациентът не реагира на първата доза суматриптан, не може да се приеме втора доза за същата атака. В тези случаи атаката може да бъде лекувана с ацетилсалицилова киселина, ацетилсалицилова киселина или нестероидни противовъзпалителни средства.
Ако пациентът е реагирал на първата доза, но симптомите се повтарят, може да се даде втора доза през следващите 24 часа, при условие че има интервал от поне 1 час между двете дози.
Максималната доза за 24 часа е две инжекции от 6 mg (12 mg).
КЛЪСТЪРЕН ГЛАВОБОЛ
Препоръчителната доза инжекционен суматриптан е единична подкожна инжекция от 6 mg за всеки пристъп на главоболие. Максималната доза за 24 часа е две 6 mg инжекции (12 mg), с минимален интервал от 1 час между двете дози.
§ Деца и юноши (под 18 години)
Използването на инжекционен суматриптан не се препоръчва при деца и юноши поради недостатъчни данни за безопасността и ефикасността.
§ Възрастни хора (над 65 години)
Има ограничен опит с употребата на суматриптан при пациенти на възраст над 65 години. Фармакокинетиката не се различава значително от тази на по -младата популация, но докато не се получат допълнителни клинични данни, употребата на суматриптан при пациенти над 65 години не се препоръчва.
04.3 Противопоказания
Свръхчувствителност към активното вещество или към някое от помощните вещества, изброени в точка 6.1.
Суматриптан не трябва да се използва при пациенти, които са имали инфаркт на миокарда или имат исхемична болест на сърцето, коронарен вазоспазъм (стенокардия на Принцметал), периферно съдово заболяване или признаци или симптоми, свързани с исхемична болест на сърцето.
Суматриптан не трябва да се дава на пациенти с анамнеза за мозъчно -съдов инцидент (CVA) или преходна исхемична атака (TIA).
Суматриптан не трябва да се прилага при пациенти с тежко чернодробно увреждане.
Употребата на суматриптан е противопоказана при пациенти с умерена и тежка хипертония и лека неконтролирана хипертония.
Едновременното приложение на ерготамин или ерготаминови производни (включително метисергид) или който и да е агонист на триптан / 5-хидрокситриптамин (5-НТ1) рецептор е противопоказано (вж. Точка 4.5).
Едновременното приложение на инхибитори на моноаминооксидазата (MAOI) и суматриптан е противопоказано.
Суматриптан не трябва да се използва в рамките на 2 седмици след спиране на лечението с инхибитор на моноаминооксидазата.
04.4 Специални предупреждения и подходящи предпазни мерки при употреба
Филмирани таблетки
Суматриптан трябва да се използва само след ясна диагноза мигрена.
Инжекционен разтвор за подкожна употреба
Суматриптан трябва да се използва само след ясна диагноза на мигрена или клъстерно главоболие.
Суматриптан за инжектиране не трябва да се прилага интравенозно.
Всички фармацевтични форми
Употребата на суматриптан не е показана при лечение на хемиплегична, базиларна или офталмоплегична мигрена.
Както при другите терапии за лечение на остра мигренозна атака, трябва да се внимава да се изключат други потенциално сериозни неврологични състояния.
Трябва да се има предвид, че мигренарите могат да представляват повишен риск от някои мозъчно -съдови събития (например CVA, TIA).
Приложението на суматриптан може да бъде придружено от преходни симптоми, включително болка в гърдите и стягане, които могат да бъдат интензивни и да засегнат гърлото (вж. Точка 4.8). Ако се смята, че тези симптоми са показателни за исхемична болест на сърцето, не трябва да се дават допълнителни дози суматриптан и да се прави подходяща оценка.
Суматриптан трябва да се прилага с повишено внимание при пациенти с лека контролирана хипертония, тъй като при малка част от пациентите са наблюдавани преходни повишения на кръвното налягане и периферната съдова резистентност (вж. Точка 4.3).
Има редки постмаркетингови съобщения за пациенти със серотонинов синдром (който включва променен психичен статус, автономна нестабилност и невромускулни аномалии) след употреба на селективен инхибитор на обратното захващане на серотонин (SSRI) и суматриптан. Съобщава се за серотонинов синдром след едновременно лечение с триптани и инхибитори на обратното захващане на серотонин и норепинефрин (SNRIs).
Ако едновременното лечение на суматриптан със SSRI / SNRI е клинично оправдано, се препоръчва подходящо наблюдение на пациента (вж. Точка 4.5).
Суматриптан трябва да се прилага с повишено внимание при пациенти със състояния, които могат значително да променят абсорбцията, метаболизма и екскрецията на лекарството, като например в случай на чернодробна или бъбречна недостатъчност.
Суматриптан трябва да се използва с повишено внимание при пациенти с епилепсия и / или анамнеза за гърчове или други рискови фактори, които понижават праговото ниво на гърчовете, тъй като са съобщени гърчове във връзка със суматриптан (вж. Точка 4.8).
Пациентите с известна свръхчувствителност към сулфонамиди могат да проявят алергична реакция след прилагане на суматриптан. Реакциите могат да варират от кожна свръхчувствителност до анафилаксия.
Доказателствата за кръстосана реактивност са ограничени, но трябва да се внимава, преди да се използва ресуматриптан при тези пациенти.
Нежеланите реакции могат да се появят по -често при едновременната употреба на триптани и препарати от жълт кантарион (Hypericum perforatum).
Продължителната употреба на всякакъв вид обезболяващо средство при главоболие може да го влоши. Ако това се случи или се подозира, трябва да се потърси лекарска помощ и лечението да се прекрати.
Диагноза главоболие от прекомерна употреба на лекарства за главоболие трябва да се подозира при пациенти, които имат чести или ежедневни главоболия въпреки (или поради) редовната употреба на лекарства за главоболие.
Препоръчителната доза суматриптан не трябва да се превишава.
Суматриптан не трябва да се дава на пациенти с рискови фактори за исхемична болест на сърцето, включително тези пациенти, които са тежки пушачи или използват заместващи никотин терапии, без първо да се направи сърдечно -съдова оценка (вж. Точка 4.3). Особено внимание трябва да се обърне на жени и мъже в постменопауза на възраст над 40 години, при които тези рискови фактори са налице. Тези оценки обаче може да не идентифицират всеки пациент със сърдечно заболяване и в много редки случаи са настъпили сериозни сърдечни събития при пациенти без основно сърдечно -съдово заболяване.
04.5 Взаимодействия с други лекарствени продукти и други форми на взаимодействие
Няма данни за взаимодействия с пропранолол, флунаризин, пизотифен или алкохол.
Данните за взаимодействията с ерготамин-съдържащи препарати или други триптани / 5-НТ1 рецепторни агонисти са ограничени. Има теоретична възможност за повишен риск от коронарен вазоспазъм, поради което едновременното приложение е противопоказано (вж. Точка 4.3).
Продължителността на времето, което трябва да мине между употребата на суматриптан и препарати, съдържащи ерготамин или други триптани / 5-НТ1 рецепторни агонисти, не е известно. Това също ще зависи от дозите и видовете използвани продукти. Ефектите може да са пристрастяващи. Препоръчваме да изчакате поне 24 часа след използване на препарати, съдържащи ерготамин или други триптани / 5-НТ1 рецепторни агонисти, преди да приложите суматриптан. Обратно, препоръчително е да изчакате поне 6 часа след употребата на суматриптан, преди да приложите продукт, съдържащ ерготамин, и най-малко 24 часа преди да приложите друг агонист на триптан / 5-НТ1 рецептор.
Може да възникне взаимодействие между суматриптан и МАО -инхибитори и едновременното приложение е противопоказано (вж. Точка 4.3).
Има редки постмаркетингови съобщения за пациенти със серотонинов синдром (който включва променен психичен статус, автономна нестабилност и нервно-мускулни аномалии) след употребата на SSRIs и суматриптан. Съобщава се и за серотонинов синдром след едновременно лечение с триптани и SNRIs (вж. точка 4.4).
04.6 Бременност и кърмене
Бременност
Има постмаркетингови данни за употребата на суматриптан през първия триместър на бременността при над 1000 жени. Въпреки че тези данни не съдържат достатъчно информация, за да се направят твърди заключения, те не разкриват повишен риск от вродени дефекти. Опит с употребата суматриптан през втория и третия триместър е ограничен.
Експерименталните проучвания върху животни не показват директни тератогенни ефекти или опасни ефекти в пери или постнаталното развитие. Въпреки това, при зайци може да настъпи ембрионална и фетална смърт (вж. Точка 5.3).
Прилагането на суматриптан трябва да се има предвид само ако ползата за майката е по -голяма от възможния риск за плода.
Време за хранене
След подкожно приложение е показано, че суматриптан се екскретира в кърмата. Излагането на кърмачета на лекарството може да бъде сведено до минимум, като се избягва кърменето през 12 -те часа след лечението, през което време количеството произведено кърма трябва да се елиминира.
04.7 Ефекти върху способността за шофиране и работа с машини
Не са провеждани проучвания за способността за шофиране или работа с машини.
Мигрената или нейното лечение със суматриптан може да причини сънливост.Това може да повлияе на способността за шофиране или работа с машини.
04.8 Нежелани реакции
Нежеланите реакции са изброени по -долу по системо -органни класове и честота. Честотите се дефинират като: много чести (> 1/10), общи (> 1/100, 1/1000, 1/10000,
Всички фармацевтични форми:
Нарушения на имунната система
С неизвестна честота: реакции на свръхчувствителност, които могат да варират от кожна свръхчувствителност (като копривна треска) до анафилаксия.
Нарушения на нервната система
Чести: замаяност, сънливост, сензорни нарушения, включително парестезия и хипоестезия.
С неизвестна честота: гърчове, въпреки че някои от тези случаи са настъпили при пациенти с анамнеза за гърчове или съпътстващи състояния, предразполагащи към гърчове. Има съобщения и при пациенти, за които такива предразполагащи фактори не са очевидни.
Тремор, дистония, нистагъм, скотома.
Очни нарушения
С неизвестна честота: трептене на зрението, диплопия, нарушено зрение. Загуба на зрение, включително случаи на трайни дефекти. Очни нарушения обаче могат да възникнат и по време на самата мигренозна атака.
Сърдечни патологии
С неизвестна честота: брадикардия, тахикардия, сърцебиене, сърдечни аритмии, преходни промени на ЕКГ от исхемичен тип, коронарен вазоспазъм, стенокардия, миокарден инфаркт (вж. Точки 4.3 и 4.4).
Съдови патологии
Чести: преходно повишаване на кръвното налягане, настъпило скоро след приложението. Зачервяване.
С неизвестна честота: хипотония, феномен на Рейно.
Дихателни, гръдни и медиастинални нарушения
Чести: диспнея.
Стомашно -чревни нарушения
Чести: При някои пациенти се съобщава за гадене и повръщане, но не е ясно дали това е свързано със суматриптан или с вече съществуващи състояния.
С неизвестна честота: исхемичен колит.
С неизвестна честота: диария.
Нарушения на мускулно -скелетната система и съединителната тъкан
Чести: усещане за тежест (обикновено преходно, може да бъде интензивно и може да засегне всяка част на тялото, включително гърдите и гърлото). Миалгия.
С неизвестна честота: скованост на шията.
С неизвестна честота: артралгия.
Общи нарушения и състояния на мястото на приложение
Чести: болка, усещане за топлина или студ, натиск или стягане (тези събития обикновено са преходни и могат да бъдат интензивни и могат да засегнат всяка част на тялото, включително гърдите и гърлото);
чувство на слабост, умора (и двете събития са до голяма степен леки до умерени по интензивност и преходни).
Диагностични тестове
Много редки: Понякога са наблюдавани леки промени в чернодробните функционални тестове.
Психични разстройства
С неизвестна честота: тревожност.
Нарушения на кожата и подкожната тъкан
С неизвестна честота: хиперхидроза.
Само инжекционен разтвор за подкожна употреба :
Най -честите нежелани реакции, свързани с подкожно лечение със суматриптан, са:
Общи нарушения и състояния на мястото на приложение
Много чести: преходна болка на мястото на инжектиране.
Много чести: На мястото на инжектиране са докладвани също усещане за парене, оток, еритем, екхимоза и кървене.
Въпреки че няма налични данни за директно сравнение, зачервяването, парестезията, топлината, усещането за натиск и тежестта могат да бъдат по -чести след прилагане на инжекционен суматриптан.
Обратно, гаденето, повръщането и умората изглеждат по -рядко след прилагане на инжекционен суматриптан от таблетките.
Докладване на предполагаеми нежелани реакции
Съобщаването на предполагаеми нежелани реакции, настъпили след разрешаване на лекарствения продукт, е важно, тъй като позволява непрекъснато проследяване на съотношението полза / риск на лекарствения продукт. От медицинските специалисти се изисква да съобщават всяка подозирана нежелана реакция чрез националната система за докладване. "Адрес: http : //www.agenziafarmaco.gov.it/it/responsabili.
04.9 Предозиране
Симптоми и признаци
Филмирани таблетки
Дозите до 100 mg през устата не са свързани с други странични ефекти, освен споменатите по -горе.
Инжекционен разтвор за подкожна употреба
Има съобщения за предозиране с инжекционен суматриптан.
Пациентите са получавали единични подкожни инжекции до 12 mg без значителни нежелани реакции. Дозите до 16 mg подкожно не са свързани с други странични ефекти, освен споменатите по -горе.
Лечение
Всички фармацевтични форми
В случай на предозиране, пациентът трябва да бъде проследяван най -малко десет часа и при необходимост да се започне подходяща поддържаща грижа. Ефектите от хемодиализата или перитонеалната диализа върху плазмените концентрации на суматриптан са неизвестни.
05.0 ФАРМАКОЛОГИЧНИ СВОЙСТВА
05.1 Фармакодинамични свойства
Фармакотерапевтична група: селективни срещу мигрена агонисти на 5НТ1 рецептори.
ATC код: N02CC01.
Механизъм на действие
Суматриптан е селективен съдов агонист на серотониновите 5НТ1 D рецептори, като по този начин е лишен от интерференция с другите подтипове серотонинергични рецептори (5НТ2 - 5НТ7). 5HT1D рецепторът е идентифициран главно в мозъчните съдове и медиира вазоконстрикция. Фармакологичните проучвания при животни показват, че суматриптан действа, като избирателно форсира циркулацията на артериалните каротиди, без да променя мозъчния кръвен поток. Каротидната циркулация напоява допълнителните и вътречерепните тъкани като менингите и се смята, че разширяването на тези съдове и / или образуването на оток е в основата на патогенетичния механизъм на мигрена при хората.
Освен това експерименталните доказателства от проучвания върху животни показват, че суматриптан може да инхибира активността на тригеминалния нерв.
Фармакодинамични ефекти
Клиничният отговор започва 10-15 минути след подкожна инжекция от 6 mg, 15 минути след 20 mg интраназално приложена доза и приблизително 30 минути след 25 mg ректална доза.
След прилагане на 50 mg или 100 mg филмирани таблетки, появата на облекчаване на болката настъпва съответно след 30 и 20 минути при малък процент от пациентите и процента на участниците, повлияващи се на терапията, с облекчаване на болката за повече от 2 часа , прогресивно нараства до 67% при 72% от пациентите, в сравнение с 42% от пациентите, лекувани с плацебо. При малък процент от пациентите пълната свобода от болка започва съответно след 33 и 26 минути и процентът продължава да нараства до 40% и 47% от пациентите без болка за 2 часа, в сравнение с 15% от пациентите, лекувани с плацебо.
Проведени са няколко плацебо контролирани клинични изпитвания за определяне на поносимостта и ефикасността на пероралния суматриптан при 600 юноши от 12 до 17 години с мигрена. Тези проучвания не показват значими разлики между плацебо и всяка доза суматриптан при облекчаване на главоболие за 2 часа постдоза Профилът на нежеланите ефекти на пероралния суматриптан при юноши на възраст от 12 до 17 години е подобен на този, докладван в проучвания при възрастни.
05.2 Фармакокинетични свойства
Фармакокинетичният профил на суматриптан не изглежда да бъде значително повлиян от пристъпите на мигрена.
Абсорбция
Инжекционен разтвор за подкожна употреба
След подкожно приложение суматриптан има висока средна бионаличност (96%); пикови серумни концентрации се достигат за 25 минути.
След подкожна доза от 6 mg, средните пикови концентрации са 72 ng / mL.
Филмирани таблетки
След доза от 100 mg средните пикови плазмени концентрации са 54 ng / ml. Средната абсолютна бионаличност след перорално приложение е 14%; това отчасти се дължи на предсистемния метаболизъм и отчасти на непълната абсорбция.
Суматриптан Cmax се повишава с 15% след прилагане на филмирани таблетки, приемани с храна с високо съдържание на мазнини.
Разпределение
Свързването с плазмените протеини е ниско (14-21%); средният общ обем на разпределение е 170 литра.
Метаболизъм
Основният метаболит, производен на индол оцетна киселина аналог на суматриптан, се екскретира главно в урината, в която присъства както в свободна киселина, така и в конюгирана глюкуронидна форма. Той няма известна 5HT1 или 5HT2 активност. Не са установени незначителни метаболити.
Елиминиране
Елиминационният полуживот е приблизително 2 часа.
Средният общ плазмен клирънс е приблизително 1160 mL / min, средният бъбречен плазмен клирънс е приблизително 260 mL / min.
Небъбречният клирънс е приблизително 80% от общия клирънс.
Специални популации пациенти
Филмирани таблетки
След перорално приложение предсистемният клирънс се намалява при пациенти с чернодробна недостатъчност, което води до повишаване на плазмените нива на суматриптан.
Клинични изследвания
Филмирани таблетки
Времето до настъпване на терапевтичния ефект на суматриптан 50 mg и 100 mg филмирани таблетки се оценява при възрастни в две рандомизирани, двойно-слепи, плацебо-контролирани проучвания, идентични по дизайн. Данните от тези проучвания бяха комбинирани, за да се получат индивидуални резултати за всяко крайна точка. Като цяло, времето за облекчаване на болката и времето за пълна свобода на болката са докладвани при 2696 пациенти с умерена до тежка мигренозна болка в групите със суматриптан 50 mg, 100 mg и плацебо. Кривите за облекчаване на болката (дефинирани като намаляване на тежестта на болката от умерена или тежка до лека или липсваща) бяха генерирани за суматриптан и плацебо за период от 2 часа след приема на лечението. L "Интервалът от време на началото на облекчаването на болката беше дефинирано като най -ранното време, когато е достигната статистическа значимост в сравнение с плацебо и впоследствие се поддържа през всички следващи моменти на кривата от 0 до 2 часа.
Свободата на болката (дефинирана като намаляване на интензивността на болката от тежка или умерена до липса на болка) се оценява по същата методология.
Процентът на пациентите, които постигат облекчаване на болката или освобождаване на болката в рамките на 2 часа след лечението, е значително по -висок при субекти, които са получавали суматриптан (50 mg или 100 mg) в сравнение с тези, които са получавали плацебо (p
От обединения анализ на данните интервалът за облекчаване на болката при суматриптан 50 mg и 100 mg филмирани таблетки е съответно 30 минути и 20 минути. От този момент нататък процентът на отговорилите субекти продължава да нараства, до 67% и 72% от пациентите, постигащи облекчаване на болката, съответно за 50 mg и 100 mg, 2 часа след лечението, в сравнение с 42% от пациентите в плацебо групата.
От обединения анализ на данните, интервалът от време до появата на болката за суматриптан 50 mg и 100 mg филмирани таблетки е съответно 33 минути и 26 минути. От този момент нататък процентът на отговорилите пациенти продължи да нараства, достигайки 40% и 47% от безболезнените за съответно 50 mg и 100 mg, 2 часа след лечението., В сравнение с 15% от пациентите в плацебо група.
05.3 Предклинични данни за безопасност
Канцерогенеза, мутагенеза
Суматриптан в проучвания инвитро и при животното е установено, че няма генотоксична и канцерогенна активност.
Репродуктивна токсичност
Таблетки
В проучване за фертилитета при плъхове, пероралните дози суматриптан, които доведоха до плазмени нива приблизително 200 пъти по -високи от тези, наблюдавани при хора след перорална доза от 100 mg, бяха свързани с намаляване на успеха на осеменяването.
Този ефект не се наблюдава при подкожно проучване, където максималните плазмени нива са приблизително 150 пъти по -високи от тези при хора по орален път.
Инжекционен разтвор за подкожна употреба
В проучване за фертилитета при плъхове пероралните дози суматриптан, водещи до плазмени нива приблизително 150 пъти по -високи от тези, наблюдавани при хора след подкожна доза от 6 mg, са свързани с намаляване на успеха на осеменяването.
Този ефект не се наблюдава при подкожно проучване, където максималните плазмени нива са приблизително 100 пъти над тези при хората по орален път.
Бременност и кърмене
Не са наблюдавани тератогенни ефекти при плъхове или зайци, а суматриптан не повлиява постнаталното развитие при плъхове.
Приложен на бременни зайци през целия период на органогенеза, суматриптан понякога води до ембриолеталност при дози, достатъчно високи, за да предизвика токсичност при майките.
06.0 ФАРМАЦЕВТИЧНА ИНФОРМАЦИЯ
06.1 Помощни вещества
Предварително напълнени спринцовки: натриев хлорид, вода за инжекции
100 mg филмирани таблетки: безводен двуосновен калциев фосфат, микрокристална целулоза, натриев бикарбонат, кроскармелоза натрий, магнезиев стеарат, хипромелоза, титанов диоксид (Е 171), глицерол триацетат
50 mg филмирани таблетки: безводен двуосновен калциев фосфат, микрокристална целулоза, натриев бикарбонат, кроскармелоза натрий, магнезиев стеарат, хипромелоза, титанов диоксид (Е 171), глицеролов триацетат, червен железен оксид (Е 172).
06.2 Несъвместимост
Не е от значение.
06.3 Срок на валидност
Инжекционен разтвор: 2 години.
Филмирани таблетки: 2 години.
06.4 Специални условия на съхранение
Филмирани таблетки: Съхранявайте при температура не по-висока от 30 ° C
Предварително напълнени спринцовки: съхранявайте в оригиналната опаковка, за да предпазите продукта от светлина.
След употреба не изхвърляйте празни контейнери в околната среда.
06.5 Естество на непосредствената опаковка и съдържанието на опаковката
Инжекционен разтвор за подкожна употреба:
-2 предварително напълнени спринцовки от 6 mg с автоинжектор PENKIT
Филмирани таблетки
-4 филмирани таблетки от 100 mg в блистери OPA-Al-PVC / Al
-4 филмирани таблетки от 50 mg в блистери с OPA-Al-PVC / Al
06.6 Инструкции за употреба и боравене
Иглите и спринцовките могат да бъдат опасни и трябва да се изхвърлят правилно и безопасно.
07.0 Притежател на разрешението за търговия
GlaxoSmithKline S.p.A. - Via A. Fleming, 2 - Verona.
08.0 НОМЕР НА РАЗРЕШЕНИЕТО ЗА ПОТРЕБЕНИЕ
IMIGRAN 6 mg / 0,5 ml инжекционен разтвор за подкожна употреба -
2 предварително напълнени спринцовки с PENKIT A.I.C.: 027975061 автоинжектор
IMIGRAN 100 mg филмирани таблетки - 4 таблетки A.I.C.: 027975059
IMIGRAN 50 mg филмирани таблетки - 4 таблетки A.I.C.: 027975073
09.0 ДАТА НА ПЪРВО РАЗРЕШЕНИЕ ИЛИ ПОДНОВЯВАНЕ НА РАЗРЕШЕНИЕТО
IMIGRAN 6 mg инжекционен разтвор за подкожно приложение-2 предварително напълнени спринцовки с автоинжектор PENKIT: 27 юли 1993 г. / декември 2006 г.
IMIGRAN 100 mg филмирани таблетки: 28 ноември 1991 г. / декември 2006 г.
IMIGRAN 50 mg филмирани таблетки: 11 юли 2001 г. / декември 2006 г.
10.0 ДАТА НА ПРЕГЛЕД НА ТЕКСТА
Декември 2013 г.













---allenamento-recupero-alimentazione.jpg)