Активни съставки: Езетимиб, Симвастатин
INEGY 10 mg / 10 mg
INEGY 10 mg / 20 mg
INEGY 10 mg / 40 mg
INEGY 10 mg / 80 mg таблетки
Показания Защо се използва Inegy? За какво е?
INEGY съдържа активните вещества езетемиб и симвастатин. INEGY е лекарство, което се използва за намаляване на нивата на общия холестерол, "лошия" холестерол (LDL холестерол) и мастните вещества, наречени триглицериди в кръвта. В допълнение, INEGY повишава нивата на "добър" холестерол (HDL холестерол).
INEGY действа по два начина за понижаване на холестерола. Активното вещество езетимиб намалява абсорбирания в храносмилателния тракт холестерол. Активната съставка симвастатин, която принадлежи към класа "статини", инхибира производството на холестерол, синтезиран от организма.
Холестеролът е едно от няколкото мастни вещества, открити в кръвта. Общият холестерол се състои главно от LDL холестерол и HDL холестерол.
LDL холестеролът често се нарича "лош" холестерол, защото може да се натрупа в стените на артериите и да образува плаки. С течение на времето това натрупване на плака може да доведе до стесняване на артериите. Това стесняване може да забави или блокира притока на кръв към жизненоважни органи като сърцето и мозъка. Това блокиране на притока на кръв може да причини инфаркт или инсулт.
HDL холестеролът често се нарича "добър" холестерол, защото помага да се предотврати натрупването на лош холестерол в артериите и предпазва от сърдечни заболявания.
Триглицеридите са друга форма на мазнини в кръвта, която може да увеличи риска от сърдечни заболявания.
INEGY се използва за пациенти, които не могат да контролират нивата на холестерола си само с диета. Докато приемате това лекарство, все пак трябва да спазвате диета за понижаване на холестерола
. INEGY се използва като добавка към диетата за понижаване на холестерола, ако имате:
- повишени нива на холестерол в кръвта (първична хиперхолестеролемия) [фамилна и несемейна хетерозиготна] или повишени нива на кръвни мазнини (смесена хиперлипидемия):
- които не са добре контролирани само от статини;
- за които сте приемали лечение със статин и езетимиб като отделни таблетки;
- наследствено заболяване (хомозиготна фамилна хиперхолестеролемия), което повишава нивата на холестерола в кръвта. Възможно е да се лекувате и с други лечения.
INEGY не ви помага да отслабнете.
Противопоказания Когато Inegy не трябва да се използва
Не приемайте INEGY, ако:
- сте алергични (свръхчувствителни) към „езетимиб, симвастатин или към някоя от останалите съставки на това лекарство (изброени в точка 6: Съдържание на опаковката и друга информация)
- в момента има чернодробни проблеми
- сте бременна или кърмите
- приемате лекарства (и) с едно или повече от следните активни вещества:
- итраконазол, кетоконазол, позаконазол или вориконазол (използва се за лечение на гъбични инфекции)
-еритромицин, кларитромицин или телитромицин (използвани за лечение на инфекции)
- ХИВ протеазни инхибитори като индинавир, нелфинавир, ритонавир и саквинавир (HIV протеазните инхибитори се използват за лечение на HIV инфекции)
- боцепревир или телапревир (използвани за лечение на инфекции с вируса на хепатит С)
- нефазодон (използван за лечение на депресия)
- кобицистат
- гемфиброзил (използван за понижаване на холестерола)
- циклоспорин (често използван при пациенти с трансплантирани органи)
- даназол (хормон, създаден от човека, използван за лечение на ендометриоза, състояние, при което лигавицата на утробата расте извън утробата).
- приемате или през последните 7 дни сте приемали или сте получавали лекарство, наречено фузидова киселина (използвано за лечение на бактериална инфекция).
Не приемайте повече от 10 mg / 40 mg INEGY, ако приемате ломитапид (използван за лечение на сериозно и рядко състояние на генетичен холестерол)
Посъветвайте се с Вашия лекар, ако не сте сигурни дали лекарството, което използвате, е едно от изброените по -горе.
Предпазни мерки при употреба Какво трябва да знаете, преди да приемете Inegy
Кажете на Вашия лекар:
- на всички ваши медицински състояния, включително алергии.
- ако консумирате големи количества алкохол или ако някога сте имали чернодробно заболяване. В този случай INEGY може да не е подходящ за вас.
- ако Ви предстои операция. Може да се наложи да спрете приема на INEGY за кратко.
- ако сте азиатски, като различна доза може да е подходяща за Вас.
Вашият лекар трябва да Ви направи кръвен тест, преди да приемете INEGY и ако имате симптоми на чернодробни проблеми, докато приемате INEGY. Този анализ се прави, за да се установи дали черният дроб функционира правилно.
Вашият лекар може също да назначи кръвни изследвания за проверка на чернодробната функция след започване на терапията с INEGY.
Докато се лекувате с това лекарство, Вашият лекар внимателно ще провери дали нямате диабет или нямате риск от развитие на диабет. Имате риск от развитие на диабет, ако имате високи нива на кръвна захар и мазнини, имате наднормено тегло и високо кръвно налягане.
Уведомете Вашия лекар, ако имате тежко белодробно заболяване.
Приложението на INEGY с фибрати (някои видове лекарства за понижаване на холестерола) трябва да се избягва, тъй като употребата на INEGY с фибрати не е проучена.
Свържете се незабавно с Вашия лекар, ако имате мускулни болки, мускулна чувствителност и мускулна слабост по неустановени причини, тъй като мускулните проблеми рядко могат да бъдат тежки и да доведат до увреждане на мускулната тъкан, причиняващо увреждане на бъбреците и много рядко са настъпили смъртни случаи.
Рискът от мускулно увреждане е по -голям при по -високи дози INEGY, особено при доза от 10 mg / 80 mg. Рискът от мускулно увреждане също е по -голям при някои пациенти. Уведомете Вашия лекар, ако някое от следните се отнася за Вас:
- имате бъбречни проблеми
- имате проблеми с щитовидната жлеза
- е на 65 или повече години
- е женска
- някога сте имали мускулни проблеми, докато приемате лекарства за понижаване на холестерола, наречени "статини" (като симвастатин, аторвастатин и розувастатин) или фибрати (като гемфиброзил и безафибрат)
- Вие или Вашето близко семейство имате наследствено мускулно заболяване.
Кажете също на Вашия лекар или фармацевт, ако имате постоянна мускулна слабост. Може да са необходими допълнителни тестове и лекарства за диагностициране и лечение на това състояние.
Деца и юноши
Употребата на INEGY не се препоръчва при деца под 10 -годишна възраст.
Взаимодействия Кои лекарства или храни могат да променят ефекта на Inegy
Уведомете Вашия лекар, ако приемате, наскоро сте приемали или е възможно да приемете други лекарства с някое от следните активни вещества. Приемът на INEGY с някое от следните лекарства може да увеличи риска от мускулни проблеми (някои вече са споменати по -горе в раздел „Не приемайте INEGY ако“):
- циклоспорин (често се използва при пациенти, получили трансплантация на орган)
- даназол (изкуствен хормон, използван за лечение на ендометриоза, състояние, при което лигавицата на матката расте извън матката)
- лекарства с активно вещество като итраконазол, кетоконазол, флуконазол, позаконазол или вориконазол (използвани за лечение на гъбични инфекции)
- фибрати с активни съставки като гемфиброзил и безафибрат (използвани за понижаване на холестерола)
- еритромицин, кларитромицин, телитромицин или фузидова киселина (използвани за лечение на бактериални инфекции). Не приемайте фузидова киселина, докато използвате това лекарство. Вижте също параграф 4 от тази листовка.
- ХИВ протеазни инхибитори като индинавир, нелфинавир, ритонавир и саквинавир (използвани за лечение на СПИН)
- боцепревир или телапревир (използвани за лечение на инфекции с вируса на хепатит С)
- нефазодон (използван за лечение на депресия)
- лекарства с активното вещество кобицистат
- амиодарон (използван за лечение на неравномерен сърдечен ритъм)
- верапамил, дилтиазем или амлодипин (използвани за лечение на високо кръвно налягане, гръдна болка, свързана със сърдечно заболяване или друго сърдечно заболяване)
- ломитапид (използван за лечение на сериозно и рядко състояние на генетичен холестерол
- високи дози (1 g или повече на ден) ниацин или никотинова киселина (използвани също за понижаване на холестерола)
- колхицин (използван за лечение на подагра).
В допълнение към изброените по -горе лекарства, моля информирайте Вашия лекар или фармацевт, ако приемате или наскоро сте приемали други лекарства, включително тези, отпускани без рецепта.По -специално, кажете на Вашия лекар, ако приемате някое от следните:
- лекарства с активна съставка за предотвратяване на образуването на кръвни съсиреци, като варфарин, флуиндион, фенпрокумон или аценокумарол (антикоагуланти)
- холестирамин (използван също за понижаване на холестерола), тъй като влияе върху начина на действие на INEGY
- фенофибрат (използван също за понижаване на холестерола)
- рифампицин (използван за лечение на туберкулоза).
Трябва също да кажете на всеки лекар, който предписва ново лекарство, че приемате INEGY.
INEGY с храна и напитки
Сокът от грейпфрут съдържа едно или повече вещества, които променят метаболизма на някои лекарства, включително INEGY. Консумацията на сок от грейпфрут трябва да се избягва, тъй като това може да увеличи риска от мускулни проблеми.
Предупреждения Важно е да знаете, че:
Бременност и кърмене
Не използвайте INEGY, ако сте бременна, възнамерявате да забременеете или ако подозирате бременност. Ако забременеете, докато приемате INEGY, спрете да го приемате незабавно и се свържете с Вашия лекар. INEGY не трябва да се използва по време на кърмене, тъй като не е известно дали лекарството преминава в кърмата.
Посъветвайте се с Вашия лекар или фармацевт, преди да приемете каквото и да е лекарство.
Шофиране и работа с машини
Не се очаква INEGY да повлияе на способността ви да шофирате или работите с машини. Трябва обаче да се има предвид, че някои хора са почувствали замаяност след приема на INEGY.
INEGY съдържа лактоза
Таблетките INEGY съдържат захар, лактоза. Ако Вашият лекар Ви е казал, че имате „непоносимост към някои захари, свържете се с него, преди да приемете този лекарствен продукт.
Дозировка и начин на употреба Как да използвате Inegy: Дозировка
Вашият лекар ще определи коя таблетка е подходяща за Вас, въз основа на текущото Ви лечение и Вашия рисков профил.
Таблетките не са счупени и не трябва да се разделят.
Винаги приемайте това лекарство точно както Ви е казал Вашият лекар или фармацевт. Ако се съмнявате, консултирайте се с Вашия лекар или фармацевт
- Преди да започнете да приемате INEGY, трябва вече да сте спазвали диета за понижаване на нивата на холестерола.
- По време на лечението с INEGY трябва да продължите да спазвате тази диета за понижаване на холестерола.
Възрастни: дозата е 1 таблетка INEGY перорално веднъж дневно.
Употреба при юноши (на възраст от 10 до 17 години): Дозата е 1 таблетка INEGY перорално веднъж дневно (не трябва да се превишава максимална доза от 10 mg / 40 mg веднъж дневно). Дозата INEGY от 10 mg / 80 mg се препоръчва само при възрастни пациенти с много високи нива на холестерол и с висок риск от сърдечни заболявания, които не са достигнали идеалното си ниво на холестерол с най -ниските дози.
Вземете INEGY вечер. Можете да го приемате със или без храна.
Ако Вашият лекар Ви е предписал INEGY с друго лекарство за понижаване на холестерола, съдържащо активното вещество холестирамин или друг агент за задържане на жлъчните киселини, трябва да приемете INEGY най-малко 2 часа преди или 4 часа след приема на секвестриращия агент на жлъчните киселини.
Предозиране Какво да направите, ако сте приели твърде много Inegy
Ако сте приели повече от необходимата доза INEGY:
- свържете се с Вашия лекар или фармацевт.
Ако сте пропуснали да приемете INEGY:
- не приемайте двойна доза, за да компенсирате пропуснатата таблетка, просто вземете нормалната си доза INEGY на следващия ден в обичайното време.
Ако сте спрели приема на INEGY:
- говорете с Вашия лекар или фармацевт, тъй като холестеролът Ви може отново да се повиши.
Ако имате допълнителни въпроси относно употребата на това лекарство, попитайте Вашия лекар или фармацевт.
Странични ефекти Какви са страничните ефекти на Inegy
Както всички лекарства, INEGY може да предизвика нежелани реакции, въпреки че не всеки ги получава (вижте точка Какво трябва да знаете, преди да приемете INEGY).
Докладвани са следните чести нежелани реакции (могат да засегнат до 1 на 10 души):
- мускулни болки
- повишаване на стойностите на кръвните лабораторни изследвания за чернодробна (трансаминаза) и / или мускулна (СК) функция
Докладвани са следните нечести нежелани реакции (могат да засегнат до 1 на 100 души):
- повишаване на стойностите на кръвните тестове, свързани с чернодробната функция; повишаване на стойностите на пикочната киселина в кръвта; увеличаване на времето, необходимо за съсирване на кръвта; наличие на протеин в урината; намалено телесно тегло
- виене на свят главоболие; усещане за изтръпване
- болка в корема; лошо храносмилане; метеоризъм; гадене; Той се дръпна; подуване на корема; диария; суха уста; стомашни болки
- обрив; сърбеж; уртикария
- болки в ставите; мускулна болка; чувствителност; слабост или спазми; болки в шията; болка в ръцете или краката; болка в гърба
- необичайна умора или слабост; чувствам се изморен; болка в гърдите; подуване, особено на ръцете и краката
- нарушение на съня; трудно заспиване
Освен това са съобщени следните нежелани реакции при хора, приемащи INEGY или лекарства, съдържащи активните вещества езетимиб или симвастатин:
- нисък брой червени кръвни клетки (анемия); намален брой кръвни клетки, което може да причини синини / кървене (тромбоцитопения)
- загуба на усещане или слабост в ръцете и краката; лоша памет; загуба на паметта; объркване
- проблеми с дишането, включително упорита кашлица и / или задух или треска
- запек
- възпаление на панкреаса често със силна коремна болка
- възпаление на черния дроб със следните симптоми: пожълтяване на кожата и очите; сърбеж; тъмна урина или светли изпражнения; чувство на умора или слабост; загуба на апетит; чернодробна недостатъчност; камъни в жлъчния мехур или възпаление на жлъчния мехур (което може да причини коремна болка, гадене и повръщане)
- косопад; повдигнат червен обрив, понякога с лезии с форма на мишена (еритема мултиформе)
- реакция на свръхчувствителност, която включва някои от следните характеристики: свръхчувствителност (алергични реакции, включително подуване на лицето, устните, езика и / или гърлото, което може да причини затруднено дишане или преглъщане и изисква незабавно лечение, болка или възпаление на ставите, възпаление на кръвта съдове, необичайни синини, обрив и подуване, копривна треска, чувствителност на кожата към слънцето, треска, зачервяване, задух и гадене, лупусоподобни симптоми (които включват обрив, кожни проблеми) стави и ефекти върху белите кръвни клетки).
- мускулна болка; чувствителност; мускулна слабост или спазми; мускулни наранявания; проблеми с сухожилията, понякога усложнени от разкъсване на сухожилието.
- намален апетит
- горещи вълни; високо кръвно налягане
- боли
- еректилна дисфункция
- депресия
- промени в някои стойности на кръвните тестове, свързани с чернодробната функция
Допълнителни възможни нежелани реакции, съобщени при някои статини:
- нарушения на съня, включително кошмари
- сексуални затруднения
- диабет. По -вероятно е, ако имате високи нива на кръвна захар и мазнини, наднормено тегло и високо кръвно налягане.Вашият лекар ще Ви наблюдава по време на лечението с това лекарство.
- мускулна болка, чувствителност или слабост, които са постоянни, които може да не изчезнат след спиране на INEGY (неизвестна честота).
Свържете се незабавно с Вашия лекар, ако имате мускулни болки, мускулна чувствителност и мускулна слабост по неустановени причини, тъй като мускулните проблеми рядко могат да бъдат тежки и да доведат до увреждане на мускулната тъкан, причиняващо увреждане на бъбреците и много рядко са настъпили смъртни случаи.
Докладване на странични ефекти
Ако получите някакви нежелани реакции, говорете с Вашия лекар или фармацевт.Това включва всички възможни нежелани реакции, които не са изброени в тази листовка. Можете също да съобщите нежелани реакции директно чрез националната система за докладване на адрес: https://www.aifa.gov.it/content/segnalazioni-reazioni-avverse.С докладването на странични ефекти можете да помогнете да предоставите повече информация за безопасността на това лекарство
Срок на годност и задържане
- Съхранявайте това лекарство на място, недостъпно за деца.
- Не използвайте това лекарство след срока на годност, отбелязан върху опаковката след "Годен до:".
- Не съхранявайте таблетки INEGY при температури над 30 ° C.
Блистери: Съхранявайте в оригиналната опаковка, за да предпазите лекарството от светлина и влага.
Бутилки: Съхранявайте бутилките плътно затворени, за да предпазите лекарството от светлина и влага.
Не изхвърляйте никакви лекарства през отпадъчни води или битови отпадъци. Попитайте Вашия фармацевт как да изхвърлите лекарства, които вече не използвате. Това ще помогне за опазването на околната среда.
Какво означава INEGY
Активните вещества на INEGY са езетимиб и симвастатин. Всяка таблетка съдържа 10 mg езетимиб и 10 mg, 20 mg, 40 mg или 80 mg симвастатин.
Другите съставки са: бутилиран хидроксианизол, лимонена киселина монохидрат, кроскармелоза натрий, хипромелоза, лактоза монохидрат, магнезиев стеарат, микрокристална целулоза, пропилалат.
Описание на това как изглежда INEGY и съдържанието на опаковката
INEGY се предлага под формата на бели до почти бели таблетки с форма на капсула с код "311", "312", "313" или "315" от едната страна. Таблетките не са счупени и не трябва да се разделят.
INEGY се предлага в опаковки от 7, 10, 14, 28, 30, 50, 56, 84, 90, 98, мултипакет, съдържащ 98 (2 опаковки по 49), 100 или 300 таблетки.
Не всички опаковки могат да бъдат пуснати на пазара.
Източник на листовката: AIFA (Италианска агенция по лекарствата). Съдържание, публикувано през януари 2016 г. Наличната информация може да не е актуална.
За да имате достъп до най-актуалната версия, препоръчително е да получите достъп до уебсайта на AIFA (Италианска агенция по лекарствата). Отказ от отговорност и полезна информация.
01.0 ИМЕ НА ЛЕКАРСТВЕНИЯ ПРОДУКТ
INEGY 10 MG / 10 MG, 10 MG / 20 MG, 10 MG / 40 MG, 10 MG / 80 MG ТАБЛЕТКИ
02.0 КАЧЕСТВЕН И КОЛИЧЕСТВЕН СЪСТАВ
Всяка таблетка съдържа 10 mg езетимиб и 10, 20, 40 или 80 mg симвастатин.
Помощни вещества с известно действие:
Всяка таблетка от 10 mg / 10 mg съдържа 58,2 mg лактоза монохидрат.
Всяка таблетка от 10 mg / 20 mg съдържа 126,5 mg лактоза монохидрат.
Всяка таблетка от 10 mg / 40 mg съдържа 262,9 mg лактоза монохидрат.
Всяка таблетка от 10 mg / 80 mg съдържа 535.8 mg лактоза монохидрат.
За пълния списък на помощните вещества вижте точка 6.1.
03.0 ЛЕКАРСТВЕНА ФОРМА
Таблетка.
Бели до почти бели таблетки с форма на капсула с код "311", "312", "313" или "315" от едната страна.
04.0 КЛИНИЧНА ИНФОРМАЦИЯ
04.1 Терапевтични показания
Хиперхолестеролемия
INEGY е показан като добавка към диетата при пациенти с първична хиперхолестеролемия (хетерозиготна фамилна и несемейна) или със смесена хиперлипидемия, където е показано използването на комбиниран продукт:
• пациенти, които не са адекватно контролирани само със статини;
• пациенти, вече лекувани със статини и езетимиб.
INEGY съдържа езетимиб и симвастатин. Доказано е, че симвастатин (20-40 mg) намалява честотата на сърдечно-съдовите събития (вж. Точка 5.1). Все още не е доказан благоприятен ефект на езетимиб върху сърдечносъдовата заболеваемост и смъртност.
Хомозиготна семейна хиперхолестеролемия (хомозиготна IF)
INEGY е показан като добавка към диетата при пациенти с хомозиготна фамилна хиперхолестеролемия. Пациентите също могат да се подложат на допълнителни терапевтични мерки (например афереза на липопротеини с ниска плътност [LDL]).
04.2 Дозировка и начин на приложение
Дозировка
Хиперхолестеролемия
Пациентът трябва да спазва адекватен режим на хранене с ниско съдържание на мазнини и да продължи диетата по време на лечението с INEGY.
Лекарството трябва да се прилага перорално. Дозовият диапазон на INEGY е от 10 mg / 10 mg / ден до 10 mg / 80 mg / ден вечер. Дозите може да не са налични във всички държави -членки. Обичайната доза е 10 mg / 20 mg / ден. O 10 mg / 40 mg / ден, прилаган вечер като единична доза.Дозата от 10 mg / 80 mg се препоръчва само при пациенти с тежка хиперхолестеролемия и с висок риск от сърдечно -съдови усложнения, които не са постигнали терапевтични цели с по -ниски дози и когато се очаква ползите да надвишават потенциалните рискове (вж. точки 4.4 и 5.1).
Нивото на липопротеиновия холестерол с ниска плътност (LDL-C), рискът от коронарна болест на сърцето и реакцията на пациента към текущата терапия за понижаване на холестерола трябва да се имат предвид в началото на лечението или при промяна на дозата.
Дозата на INEGY трябва да бъде индивидуализирана въз основа на признатата ефикасност на различните концентрации на INEGY (вж. Точка 5.1, таблица 1) и на отговора на продължаващата понижаваща холестерола терапия. Ако е необходимо, корекциите на дозата трябва да се правят на интервали. Не по-малко повече от 4 седмици INEGY може да се прилага със или без хранене Таблетката не трябва да се разделя.
Хомозиготна фамилна хиперхолестеролемия
Препоръчителната начална доза за пациенти с хомозиготна фамилна хиперхолестеролемия е INEGY 10 mg / 40 mg / ден вечер. Дозата от 10 mg / 80 mg се препоръчва само когато се очаква ползата да надвишава потенциалните рискове (вж. По -горе; раздели 4.3 и 4.4). INEGY може да се използва при тези пациенти като адювант към други лечения за понижаване на липидите (напр. LDL афереза) или ако такива лечения не са налични.
При пациенти, приемащи ломитапид едновременно с INEGY, дозата INEGY не трябва да надвишава 10 mg / 40 mg / ден (вж. Точки 4.3, 4.4 и 4.5).
Едновременно приложение с други лекарствени продукти
Приложението на INEGY трябва да се осъществи или ≥ 2 часа преди или ≥ 4 часа след прилагането на агент за отделяне на жлъчна киселина.
При пациенти, приемащи амиодарон, амлодипин, верапамил или дилтиазем едновременно с INEGY, дозата INEGY не трябва да надвишава 10 mg / 20 mg / ден (вж. Точки 4.4 и 4.5).
При пациенти, получаващи понижаващи липидите дози ниацин (≥1 g / ден) едновременно с INEGY, дозата INEGY не трябва да надвишава 10 mg / 20 mg / ден (вж. Точки 4.4 и 4.5).
Възрастни граждани
Не се налага коригиране на дозата при пациенти в старческа възраст (вж. Точка 5.2).
Педиатрична популация
Започването на лечението трябва да се извършва под наблюдението на специалист.
Юноши ≥10 години (пубертетен статус: момчета в етап на Танер II и по-високи и момичета, които са били в период след менархе поне една година): Клиничният опит при педиатрични и юношески пациенти (10 до 17 години) е ограничен. дозата е 10 mg / 10 mg веднъж дневно вечер. Препоръчителният диапазон на дозиране е 10 mg / 10 mg до максимум 10 mg / 40 mg / ден (вж. точки 4.4 и 5.2).
Деца
Пациенти с чернодробно увреждане
Не се налага коригиране на дозата при пациенти с леко чернодробно увреждане (оценка по Child-Pugh 5 до 6). Лечението с INEGY не се препоръчва при пациенти с умерено (оценка по Child-Pugh 7 до 9) или тежко (оценка по Child-Pugh> 9) чернодробно увреждане. (Вижте точки 4.4 и 5.2).
Пациенти с увреждане на бъбреците
Не се налага промяна на дозата при пациенти с леко бъбречно увреждане (прогнозна скорост на гломерулна филтрация ≥60 ml / min / 1,73 m2). При пациенти с хронично бъбречно заболяване и прогнозна скорост на гломерулна филтрация 2, препоръчителната доза INEGY е 10 mg / 20 mg веднъж дневно вечер (вж. Точки 4.4, 5.1 и 5.2). По -високи дози трябва да се прилагат с повишено внимание.
Начин на приложение
Inegy трябва да се прилага перорално. Inegy може да се прилага като единична доза вечер.
04.3 Противопоказания
Свръхчувствителност към активното (ите) вещество (а) или към някое от помощните вещества, изброени в точка 6.1.
Бременност и кърмене (вж. Точка 4.6).
Активно чернодробно заболяване или повишени, устойчиви и неопределени стойности на серумните трансаминази.
Едновременното приложение на мощни инхибитори на CYP3A4 (средства, които повишават AUC приблизително 5 пъти или повече) (напр. Итраконазол, кетоконазол, позаконазол, вориконазол, еритромицин, кларитромицин, телитромицин, HIV протеазни инхибитори (напр. Нелфинавир), лекарство нелапредон, лекарствени вещества продукти, съдържащи кобицистат) (вж. точки 4.4 и 4.5).
Едновременно приложение на гемфиброзил, циклоспорин или даназол (вж. Точки 4.4 и 4.5).
При пациенти с хомозиготен IF едновременно приложение на ломитапид с дози INEGY 10 mg / 40 mg (вж. Точки 4.2, 4.4 и 4.5).
04.4 Специални предупреждения и подходящи предпазни мерки при употреба
Миопатия / рабдомиолиза
В постмаркетинговия опит с езетимиб са докладвани случаи на миопатия и рабдомиолиза. Повечето пациенти, които развиват рабдомиолиза, са били на едновременно лечение с езетимиб и статин. Много рядко обаче се съобщава за рабдомиолиза с езетимиб и монотерапия. Много рядко с добавка на езетимиб към други агенти, за които е известно, че са свързани с повишен риск от рабдомиолиза.
INEGY съдържа симвастатин. Симвастатин, подобно на други инхибитори на HMG-CoA редуктазата, понякога причинява миопатия, проявяваща се като мускулна болка, чувствителност или слабост, свързана с повишаване на нивата на креатин киназа (CK) над 10 пъти горната граница на нормата. Миопатията понякога се проявява като рабдомиолиза със или без остра бъбречна недостатъчност вследствие на миоглобинурия и много рядко са настъпили фатални резултати Рискът от миопатия се увеличава от високите нива на инхибиращата активност на HMG-CoA редуктазата в плазмата.
Както при другите инхибитори на HMG-CoA редуктазата, рискът от миопатия / рабдомиолиза е дозата, свързана със симвастатин.В база данни от клинични проучвания, в която 41 413 пациенти са лекувани със симвастатин, 24 747 (приблизително 60%) от които са включени в проучвания със средна стойност проследяване от поне 4 години, честотата на миопатия е приблизително 0,03%, 0,08% и 0,61% при 20, 40 и 80 mg / ден, съответно. В тези проучвания пациентите бяха внимателно наблюдавани и някои взаимодействащи лекарства бяха изключени.
В клинично проучване, при което пациенти с анамнеза за миокарден инфаркт са лекувани със симвастатин 80 mg / ден (средно проследяване от 6,7 години), честотата на миопатия е приблизително 1,0% в сравнение с честота от 0,02%, наблюдавана при пациенти лекувани с 20 mg / ден. Приблизително половината от тези случаи на миопатия са настъпили през първата година от лечението. Честотата на миопатия през всяка следваща година от лечението е приблизително 0,1% (вж. точки 4.8 и 5.1).
Рискът от миопатия е по-висок при пациенти, лекувани с INEGY 10 mg / 80 mg, отколкото при други терапии на базата на статини със сходна ефикасност при понижаване на LDL-C. Следователно, дозата INEGY 10 mg / 80 mg трябва да се използва само при пациенти с тежка хиперхолестеролемия и с висок риск от сърдечно -съдови усложнения, които не са постигнали целите на лечението с по -ниски дози и когато се очаква ползата да бъде по -голяма. Потенциални рискове. При пациенти, лекувани с INEGY 10 mg / 80 mg, за които се изисква взаимодействащ агент, трябва да се използва по-ниска доза INEGY или алтернативна схема на статини с по-нисък потенциал за лекарствени взаимодействия (вижте по-долу. Мерки за намаляване на риска от миопатия, причинена от лекарствени взаимодействия и точки 4.2, 4.3 и 4.5).
В клинично проучване, при което над 9 000 пациенти с хронично бъбречно заболяване са били рандомизирани да получават INEGY 10 mg / 20 mg дневно (n = 4,650) или плацебо (n = 4,620) (средно проследяване от 4,9 години), честотата на миопатия е 0,2% за INEGY и 0,1% за плацебо (вж. точка 4.8).
В клинично проучване, при което пациенти с висок риск от сърдечно-съдови заболявания са лекувани със симвастатин 40 mg / ден (медиана на проследяване 3,9 години), честотата на миопатия е приблизително 0,05% за пациенти. Не-китайци (n = 7,367) спрямо 0,24% за китайски пациенти (n = 5 468). Въпреки че единствената азиатска популация, оценена в това клинично проучване, е китайска, трябва да се внимава, когато се предписва INEGY на азиатски пациенти и задължително трябва да се използва най -ниската доза.
Намалена функционалност на транспортните протеини
Намалената функция на чернодробните транспортни протеини OATP може да увеличи системната експозиция на симвастатинова киселина и да увеличи риска от миопатия и рабдомиолиза.Нарушената функция може да възникне както в резултат на инхибиране от взаимодействащи лекарства (например циклоспорин), така и при пациенти носители на генотип SLCO1B1 c. 521T> C.
Пациентите, носещи генния алел SLCO1B1 (c.521T> C), кодиращи по -малко активен протеин OATP1B1, имат повишена системна експозиция на симвастатинова киселина и повишен риск от миопатия. Рискът от миопатия, свързан с висока доза (80 mg) симвастатин, е приблизително 1% като цяло, без генетично изследване. Въз основа на резултатите от проучването SEARCH, носителите на хомозиготния алел С (наричан още CC), лекувани с 80 mg, имат 15% риск от развитие на миопатия в рамките на една година, докато рискът при хетерозиготни носители на С алела (CT) е 1,5%.Относителният риск е 0,3% при пациенти с най -честия генотип (ТТ) (вж. Точка 5.2). Когато е налице, генотипирането за наличието на алел С трябва да се разглежда като част от оценката полза-риск, преди да се предпишат 80 mg симвастатин на отделни пациенти и високите дози, при тези с генотип на CC, трябва да се избягват. на този ген в генотипирането не изключва възможността за развитие на миопатия.
Измерване на нивата на креатин киназа
Нивата на КК не трябва да се измерват след тежки физически натоварвания или при наличие на някаква алтернативна причина за повишаване на КК, тъй като това може да затрудни интерпретирането на данните. Ако нивата на КК са значително повишени в началото (повече от 5 пъти горната граница на нормата), те трябва да бъдат измерени отново в рамките на 5-7 дни, за да бъдат потвърдени резултатите.
Преди лечението
Всички пациенти, които започват терапия с INEGY или увеличават дозата на INEGY, трябва да бъдат информирани за риска от миопатия и да бъдат инструктирани да съобщават незабавно всяка необяснима мускулна болка, чувствителност и слабост.
Трябва да се внимава при пациенти с предразполагащи фактори за рабдомиолиза. За да се установи базова референтна стойност, нивото на CK трябва да бъде измерено преди започване на лечението в следните случаи:
• възрастни (възраст ≥ 65 години)
• женски пол
• бъбречно увреждане
• неконтролиран хипотиреоидизъм
• лична или фамилна анамнеза за наследствени мускулни нарушения
• анамнеза за предишни епизоди на мускулна токсичност със статин или фибрат
• злоупотребата с алкохол.
В горните случаи рискът, който включва лечението, трябва да се прецени спрямо възможната полза, а в случай на лечение се препоръчва по -внимателно наблюдение на пациента. Ако пациентът е имал предишен опит с мускулни нарушения, докато е бил лекуван с фибрат или статин, лечението с който и да е продукт, съдържащ статини (като INEGY), трябва да започне само с повишено внимание. Ако нивата на КК са значително повишени в началото (повече от 5 пъти горната граница на нормата), лечението не трябва да се започва.
По време на лечението
Ако по време на лечението с INEGY пациентът съобщи за мускулна болка, слабост или спазми, трябва да се измерят нивата на КК. В случай на значително повишени нива на КК (повече от 5 пъти горната граница на нормата), при липса на интензивни упражнения, терапията трябва да се преустанови. Може да се обмисли прекратяване на лечението в случай на тежки мускулни симптоми, причиняващи ежедневен дискомфорт, дори ако стойностите на КК останат под 5 пъти горната граница на нормата. Лечението трябва да се преустанови, ако има съмнение за миопатия по някаква друга причина.
Има много редки съобщения за имунно-медиирана некротизираща миопатия (IMNM) по време или след лечение с някои статини. IMNM се характеризира клинично с персистираща проксимална мускулна слабост и повишена серумна креатинкиназа, които продължават въпреки преустановяването на лечението със статини (вж. Точка 4.8).
Ако симптомите отшумят и нивата на КК се нормализират, може да се обмисли повторно въвеждане на INEGY или друг продукт, съдържащ друг статин, в най -ниската доза и под внимателно наблюдение.
Наблюдава се по -висока честота на миопатия при пациенти, титрирани до 80 mg симвастатин (вж. Точка 5.1). Препоръчва се нивата на КК да се измерват периодично, тъй като те могат да бъдат полезни за идентифициране на субклинични случаи на миопатия. Няма обаче сигурност, че такова наблюдение ще предотврати миопатията.
Терапията с INEGY трябва временно да бъде прекъсната няколко дни преди голяма планова операция и ако се развие някакво сериозно медицинско или хирургично състояние.
Мерки за намаляване на риска от миопатия, причинена от лекарствени взаимодействия (вж. Също точка 4.5)
Рискът от миопатия и рабдомиолиза се увеличава значително от едновременната употреба на INEGY с мощни инхибитори на CYP3A4 (като итраконазол, кетоконазол, позаконазол, вориконазол, еритромицин, кларитромицин, телитромицин, инхибитори на HIV протеаза (напр. Нелфинавир, болфинавир, нелфинавир, болфинавир, болфилавир), болфилвир) нефазодон и лекарства, съдържащи кобицистат), както при циклоспорин, даназол и гемфиброзил. Употребата на тези лекарствени продукти е противопоказана (вж. Точка 4.3).
Поради наличието на симвастатин в INEGY, рискът от миопатия и рабдомиолиза също се увеличава от едновременната употреба на други фибрати, ниацин при понижаващи липидите дози (≥ 1 g / ден) или от едновременната употреба на амиодарон, амлодипин, верапамил или дилтиазем с някои дози INEGY (вж. точки 4.2 и 4.5). Рискът от миопатия, включително рабдомиолиза, може да се увеличи, когато INEGY се прилага едновременно с фузидова киселина. При пациенти с хомозиготен ИФ този риск може да се увеличи при едновременната употреба на ломитапид с INEGY (вж. Точка 4.5).
Следователно, що се отнася до инхибиторите на CYP3A4, едновременната употреба на INEGY с итраконазол, кетоконазол, позаконазол, вориконазол, инхибитори на HIV протеазата (напр. Нелфинавир), боцепревир, телапревир, еритромицин, кларитромицин, телфитромицин, съдържащи се и кофибитромицин, съдържащ 4.3 и 4.5). Ако не може да се избегне терапия с мощни инхибитори на CYP3A4 (средства, които повишават AUC приблизително 5 пъти или повече), лечението с INEGY трябва да се преустанови (и да се обмисли употребата на друг статин) по време на терапията.Освен това трябва да се внимава при комбиниране на INEGY с някои други по -малко мощни инхибитори на CYP3A4: флуконазол, верапамил, дилтиазем (вж. Точки 4.2 и 4.5). Едновременният прием на сок от грейпфрут и INEGY трябва да се избягва.
Симвастатин не трябва да се прилага едновременно с фузидова киселина. Има съобщения за рабдомиолиза (включително някои смъртни случаи) при пациенти, получаващи тази комбинация (вж. Точка 4.5). При пациенти, при които употребата на системна фузидова киселина се счита за съществена, лечението със статини трябва да се преустанови по време на лечението с фузидова киселина.Пациентите трябва да бъдат посъветвани да потърсят незабавна медицинска помощ, ако се развият симптоми. Мускулна слабост, болка или чувствителност.
Статиновата терапия може да бъде въведена отново седем дни след последната доза фузидова киселина.При изключителни обстоятелства, когато е необходима продължителна системна употреба на фузидова киселина, например за лечение на тежки инфекции, необходимостта от едновременно приложение на INEGY и фузидова киселина трябва да се прецени само за всеки отделен случай под строг лекарски контрол.
Едновременната употреба на INEGY в дози над 10 mg / 20 mg на ден и ниацин при понижаващи липидите дози (≥1 g / ден) трябва да се избягва, освен ако е вероятно клиничната полза да надвишава повишения риск от миопатия (вж. Точки 4.2 и 4.5 ).
Редки случаи на миопатия / рабдомиолиза са свързани с едновременното приложение на инхибитори на HMG-CoA редуктаза и липидо-модифициращи дози ниацин (никотинова киселина) (≥ 1 g / ден), като и двете могат да причинят миопатия, когато се прилагат самостоятелно.
В клинично проучване (средно проследяване от 3,9 години), включващо пациенти с висок риск от сърдечно-съдови заболявания и с добре контролирани нива на LDL-C върху симвастатин 40 mg / ден със или без езетимиб 10 mg, нямаше никаква допълнителна полза при сърдечно-съдови резултати с добавяне на липид-модифициращи дози ниацин (никотинова киселина) (≥1 g / ден). Следователно, лекарите обмислят комбинирана терапия със симвастатин и липид-модифициращ ниацин (никотинова киселина) (≥ 1 g / ден) или ниацин -съдържащите продукти трябва внимателно да преценят потенциалните ползи и рискове и трябва внимателно да следят пациентите за признаци или симптоми на мускулна болка, чувствителност или слабост, особено през първите месеци на терапията и когато дозите на едно или друго лекарство се увеличават.
Освен това в това проучване честотата на миопатия е приблизително 0,24% за китайски пациенти, лекувани със симвастатин 40 mg или езетимиб / симвастатин 10 mg / 40 mg, в сравнение с 1,24% за китайски пациенти, лекувани със симвастатин 40 mg или езетимиб / симвастатин 10 mg / 40 mg едновременно прилагани с никотинова киселина / ларопипрант 2000 mg / 40 mg модифицирано освобождаване. Въпреки че единствената азиатска популация, оценена в това клинично проучване, е китайската, тъй като честотата на миопатия е по-висока при китайските пациенти, отколкото при некитайските пациенти, едновременното приложение на INEGY с дози ниацин (никотинова киселина) може да промени липидния профил ( ≥ 1 g / ден) не се препоръчва при азиатски пациенти.
Acipimox е структурно свързан с ниацин. Въпреки че аципимокс не е проучен, рискът от мускулни токсични ефекти може да бъде подобен на този при ниацин.
Едновременната употреба на INEGY в дози над 10 mg / 20 mg на ден и амиодарон, амлодипин, верапамил или дилтиазем трябва да се избягва.При пациенти с хомозиготна IF, комбинираната употреба на INEGY в дози над 10 mg / 40 mg на ден с ломитапид трябва да се избягва. (Вижте раздели 4.2, 4.3 и 4.5)
Пациентите, приемащи други лекарствени продукти, за които е известно, че имат умерен инхибиторен ефект върху CYP3A4 в терапевтични дози, когато се използват едновременно с INEGY, особено с по -високи дози INEGY, могат да имат повишен риск от миопатия. В случай на едновременно приложение на INEGY с умерен инхибитор на CYP3A4 (средства, които повишават AUC приблизително 2-5 пъти), може да се наложи коригиране на дозата. За някои умерени инхибитори на CYP3A4, например дилтиазем, се препоръчва максимална доза от 10 mg / 20 mg INEGY (вж. Точка 4.2).
Безопасността и ефикасността на INEGY, прилаган с фибрати, не са проучени. Съществува повишен риск от миопатия при едновременна употреба на симвастатин и фибрати (особено гемфиброзил). Следователно едновременната употреба на INEGY и гемфиброзил е противопоказана (вж. Точка 4.3) и едновременната употреба с други фибрати не се препоръчва (вж. точка 4.5).
Чернодробни ензими
При контролирани комбинирани проучвания за дозиране, при които пациентите са лекувани с езетимиб и симвастатин, са наблюдавани последователни повишения на трансаминазите (≥ 3 пъти горната граница на нормата [ULN]) (вж. Точка 4.8).
В контролирано клинично изпитване, при което над 9 000 пациенти с хронично бъбречно заболяване са били рандомизирани да получават INEGY 10 mg / 20 mg дневно (n = 4,650) или плацебо (n = 4,620) (среден период на проследяване от 4,9 години), честотата на последователни повишения на трансаминазите (> 3 пъти ULN) е 0,7% за INEGY и 0,6% за плацебо (вж. точка 4.8).
Препоръчително е да се извършат чернодробни функционални тестове преди започване на лечението с INEGY и след това, когато е клинично показано. Пациентите, титрирани до доза 10 mg / 80 mg, трябва да се подложат на допълнителен тест преди титриране, 3 месеца след титриране до доза от 10 mg / 80 mg, и периодично след това (например на всеки шест месеца) през първата година от лечението.Особено внимание трябва да се обърне на пациенти, които развиват повишаване на серумните трансаминази и при тези пациенти кръвните изследвания трябва да се повтарят незабавно и след това да се извършват по -често. Ако нивата на трансаминазите показват доказателства за прогресия, особено ако се повишат до 3 пъти над ГГН и са постоянни, лечението с лекарства трябва да се преустанови. Имайте предвид, че ALT може да възникне от мускулите, следователно увеличаването на ALT и CK може да показва миопатия (вижте по -горе Миопатия / рабдомиолиза).
Има редки постмаркетингови съобщения за фатална и нефатална чернодробна недостатъчност при пациенти, приемащи статини, включително симвастатин. Ако по време на лечението с INEGY настъпи тежко чернодробно увреждане с клинични симптоми и / или хипербилирубинемия или жълтеница, незабавно прекратете терапията. Ако не е намерена алтернативна етиология, не започвайте отново терапията с INEGY.
INEGY трябва да се използва с повишено внимание при пациенти, които консумират значителни количества алкохол.
Чернодробно увреждане
Поради неизвестните ефекти от повишената експозиция на езетимиб при пациенти с умерено или тежко чернодробно увреждане, INEGY не се препоръчва (вж. Точка 5.2).
Захарен диабет
Някои данни показват, че статините, като класов ефект, повишават кръвната захар и при някои пациенти, с висок риск от развитие на диабет, могат да предизвикат ниво на хипергликемия, така че антидиабетната терапия е подходяща.
Този риск обаче се превъзхожда от намаляването на съдовия риск при употребата на статини и следователно не трябва да бъде причина за спиране на лечението със статини.
Пациентите в риск (глюкоза на гладно 5.6 до 6.9 mmol / L, ИТМ> 30Kg / m2, повишени нива на триглицериди, хипертония) трябва да бъдат наблюдавани както клинично, така и биохимично в съответствие с националните указания.
Педиатрична популация
Безопасността и ефикасността на езетимиб, прилаган едновременно със симвастатин при пациенти на възраст от 10 до 17 години с хетерозиготна фамилна хиперхолестеролемия, са оценени в контролирано клинично проучване при юноши юноши (етап II на Tanner или по-висок) и при момичета. поне година.
В това ограничено контролирано проучване като цяло няма ефект върху сексуалния растеж или съзряване при момчета или момичета в юношеска възраст или какъвто и да е ефект върху продължителността на менструалния цикъл при момичетата. Ефектите на езетимиб за период на лечение> 33 седмици върху сексуалния растеж и съзряване не са проучени (вж. Точки 4.2 и 4.8).
Безопасността и ефикасността на езетимиб, прилаган едновременно с дози симвастатин над 40 mg дневно, не са проучвани при педиатрични пациенти на възраст от 10 до 17 години.
Езетимиб не е проучен при пациенти на възраст под 10 години или при момичета преди менархе (вж. Точки 4.2 и 4.8).
Дългосрочната ефикасност на езетимиб при пациенти на възраст под 17 години за намаляване на заболеваемостта и смъртността при възрастни не е проучена.
Вързопи
Безопасността и ефикасността на езетимиб, прилаган с фибрати, не са установени (вж. По -горе и точки 4.3 и 4.5).
Антикоагуланти
Ако INEGY се добави към варфарин, друг кумаринов антикоагулант или флуиндион, трябва да се следи адекватно международното нормализирано съотношение (вж. Точка 4.5).
Интерстициална белодробна болест
Съобщавани са случаи на интерстициална белодробна болест при някои статини, включително симвастатин, особено при продължителна терапия (вж. Точка 4.8). Симптомите могат да включват диспнея, непродуктивна кашлица и влошаване на общото здравословно състояние (умора, загуба на тегло и треска). Ако се подозира, че пациентът е развил интерстициална белодробна болест, лечението с INEGY трябва да се преустанови.
Помощно вещество
Пациенти с редки наследствени проблеми на галактозна непоносимост, Lapp лактазен дефицит или глюкозо-галактозна малабсорбция не трябва да приемат това лекарство.
04.5 Взаимодействия с други лекарствени продукти и други форми на взаимодействие
Фармакодинамични взаимодействия
Взаимодействия с лекарства за понижаване на липидите, които могат да причинят миопатия, когато се прилагат самостоятелно
Рискът от миопатия, включително рабдомиолиза, се увеличава при едновременното приложение на симвастатин с фибрати. В допълнение, „фармакокинетичното взаимодействие на симвастатин с гемфиброзил причинява повишаване на плазмените нива на симвастатин (вижте по -долу, Фармакокинетични взаимодействия и раздели 4.3 и 4.4). Редки случаи на миопатия / рабдомиолиза са свързани с едновременното приложение на симвастатин и липидно -модифициращи дози ниацин (≥ 1 g / ден) (вж. Точка 4.4).
Фибратите могат да увеличат екскрецията на холестерол в жлъчката, което води до холелитиаза.В предклинично проучване при кучета езетимиб повишава холестерола в жлъчката в жлъчния мехур (вж. Точка 5.3). Въпреки че значението на тези предклинични данни за хора е неизвестно, едновременното приложение на INEGY с фибрати не се препоръчва (вж. Точка 4.4).
Фармакокинетични взаимодействия
Препоръките за предписване на взаимодействащи агенти са обобщени в следващата таблица (допълнителни подробности са включени в текста; вижте също раздели 4.2, 4.3 и 4.4).
Взаимодействащи лекарства, свързани с повишен риск от миопатия / рабдомиолиза
на миопатия / рабдомиолиза
Ефекти на други лекарствени продукти върху INEGY
ИНЕГИЯ
Ниацин: в проучване на 15 здрави възрастни, едновременната употреба на INEGY (10 mg / 20 mg дневно в продължение на 7 дни) доведе до малко увеличение на средните стойности на AUC на ниацин (22%) и никотинурова киселина (19%).), като NIASPAN таблетки с удължено освобождаване (1 000 mg за 2 дни и 2 000 mg за 5 дни, приемани след закуска с ниско съдържание на мазнини). В същото проучване, едновременната употреба на NIASPAN води до леко повишаване на средните стойности на AUC на езетимиб (9%), общ езетимиб (26%), симвастатин (20%) и симвастатинова киселина (35%). раздели 4.2 и 4.4).
Не са провеждани проучвания за лекарствени взаимодействия с по -високи дози симвастатин.
Езетимиб
Антиациди: Едновременното приложение на антиациди намалява скоростта на абсорбция на езетимиб, но няма ефект върху бионаличността на езетимиб. Това намаляване на скоростта на абсорбция не се счита за клинично значимо.
Холестирамин: едновременното приложение на холестирамин намалява средната площ под кривата (AUC) на общия езетимиб (езетимиб + езетимиб-глюкуронид) с приблизително 55%. По-нататъшното намаляване на липопротеиновия холестерол с ниска плътност (LDL-C) поради добавянето на INEGY към холестирамин може да бъде намалено от това взаимодействие (вж. Точка 4.2).
Циклоспорин: В проучване на осем пациенти след бъбречна трансплантация с креатининов клирънс> 50 ml / min при стабилни дози циклоспорин, прилагането на единична доза от 10 mg езетимиб води до 3.4-кратно увеличение (диапазон от 2.3-7.9 пъти) на средна AUC за общ езетимиб в сравнение със здрава контролна популация от друго проучване, лекувано само с езетимиб (n = 17) .В различно проучване, трансплантиран пациент с тежко бъбречно увреждане, приемащ циклоспорин и няколко други лекарствени продукти, показва 12 пъти по-висока "обща експозиция на" езетимиб в сравнение със свързани контроли, лекувани само с езетимиб. В двупериодно кръстосано проучване, от дванадесет здрави индивида, ежедневното приложение на 20 mg езетимиб за 8 дни с циклоспорин 100 mg еднократна доза на 7 ден средно 15% увеличение на AUC на циклоспорин (диапазон между намаляване на с 10% и увеличение с 51%) в сравнение с еднократна доза от 100 mg циклоспорин самостоятелно. Не са провеждани контролирани проучвания за ефекта на едновременното приложение на езетимиб върху експозицията на циклоспорин при пациенти с бъбречна трансплантация. Едновременното приложение на INEGY и циклоспорин е противопоказано (вж. Точка 4.3).
Вързопи: Едновременното приложение на фенофибрат или гемфиброзил повишава общите концентрации на езетимиб съответно приблизително 1,5 и 1,7 пъти. Въпреки че тези увеличения не се считат за клинично значими, едновременното приложение на INEGY с гемфиброзил е противопоказано и с други фибрати не се препоръчва (вж. Точки 4.3 и 4.4).
Симвастатин
Симвастатин е субстрат на цитохром Р450 3А4. Мощните инхибитори на цитохром Р450 3А4 увеличават риска от миопатия и рабдомиолиза чрез увеличаване на концентрацията на инхибиращата активност на HMG-CoA редуктазата в плазмата по време на терапия със симвастатин. Такива инхибитори включват итраконазол, кетоконазол, позаконазол, вориконазол, еритромицин, кларитромицин, телитромицин, HIV протеазни инхибитори (напр. Нелфинавир), боцепревир, телапревир, нефазодон и лекарствени продукти, съдържащи кобицистат. Повече от 10-кратно увеличаване на експозицията на симвастатин киселина метаболит на бета-хидрокси киселина). Телитромицин причинява 11-кратно увеличение на експозицията на симвастатинова киселина.
Комбинацията с итраконазол, кетоконазол, позаконазол, вориконазол, HIV протеазни инхибитори (напр. Нелфинавир), боцепревир, телапревир, еритромицин, кларитромицин, телитромицин, нефазодон и лекарствени продукти, съдържащи кобицистат, е противопоказана, както и с циклоспиброз даназол (4.3 секция 4.3) . Ако лечението с мощни инхибитори на CYP3A4 (средства, които повишават AUC приблизително 5 пъти или повече) е неизбежно, лечението с INEGY трябва да се преустанови (и трябва да се обмисли употребата на друг статин) по време на лечението Трябва да се внимава при комбиниране на INEGY с някои други по -малко мощни инхибитори на CYP3A4: флуконазол, верапамил или дилтиазем (вж. точки 4.2 и 4.4).
Флуконазол: Съобщавани са редки случаи на рабдомиолиза, свързани с едновременното приложение на симвастатин и флуконазол. (вж. точка 4.4).
Циклоспорин: рискът от миопатия / рабдомиолиза се увеличава от едновременното приложение на циклоспорин с INEGY; следователно употребата с циклоспорин е противопоказана (вж. точки 4.3 и 4.4.) Въпреки че механизмът не е напълно изяснен, е доказано, че циклоспорин повишава AUC на инхибиторите на HMG-CoA редуктазата. на симвастатинова киселина се дължи отчасти на инхибирането CYP3A4 и / или OATP1B1.
Даназол: рискът от миопатия и рабдомиолиза се увеличава от едновременното приложение на даназол с INEGY; следователно, употребата с даназол е противопоказана (вж. точки 4.3 и 4.4).
Гемфиброзил: гемфиброзил повишава AUC на киселинния метаболит на симвастатин в 1,9 пъти, вероятно поради инхибиране на глюкуронирането и / или OATP1B1 (вж. точки 4.3 и 4.4). Едновременното приложение с гемфиброзил е противопоказано.
Фузидова киселина: рискът от миопатия, включително рабдомиолиза, може да се увеличи при едновременното приложение на системна фузидова киселина със статини. Едновременното приложение на тази комбинация може да причини повишени плазмени концентрации и на двата агента. Механизмът на това взаимодействие (независимо дали е фармакодинамичен или фармакокинетичен или и двете) все още е неизвестен. Има съобщения за рабдомиолиза (включително някои смъртни случаи) при пациенти, получаващи тази комбинация. Ако е необходимо лечение с фузидова киселина, лечението с INEGY трябва да се преустанови по време на лечението с фузидова киселина (вж. Точка 4.4).
Амиодарон: рискът от миопатия и рабдомиолиза се увеличава при едновременното приложение на амиодарон със симвастатин (вж. точка 4.4). В клинично проучване миопатия се съобщава при 6% от пациентите, лекувани със симвастатин 80 mg и амиодарон. Следователно, дозата на INEGY не трябва да надвишава 10 mg / 20 mg на ден при пациенти на съпътстваща терапия с амиодарон.
Блокери на калциевите канали
•Верапамил: рискът от миопатия и рабдомиолиза се увеличава при едновременното приложение на верапамил със симвастатин 40 mg или 80 mg (вж. точка 4.4).
Във фармакокинетично проучване, едновременното приложение на симвастатин с верапамил води до 2,3-кратно увеличение на експозицията на симвастатинова киселина, което се дължи отчасти на инхибирането на CYP3A4. Следователно дозата INEGY не трябва да надвишава 10 mg / 20 mg на ден при пациенти, получаващи съпътстваща терапия с верапамил.
• Дилтиазем: рискът от миопатия и рабдомиолиза се увеличава при едновременно приложение на дилтиазем със симвастатин 80 mg (вж. точка 4.4). Във фармакокинетично проучване, едновременното приложение на дилтиазем и симвастатин е причинило 2,7-кратно увеличение на експозицията на симвастатинова киселина, вероятно поради инхибиране на CYP3A4. Следователно дозата INEGY не трябва да надвишава 10 mg / 20 mg на ден при пациенти, получаващи съпътстваща терапия с дилтиазем.
• Амлодипин: пациентите на съпътстваща терапия с амлодипин и симвастатин имат повишен риск от миопатия. Във фармакокинетично проучване, едновременното приложение на амлодипин е причинило 1,6-кратно увеличение на експозицията на симвастатинова киселина.Поради това дозата на INEGY не трябва да надвишава 10 mg / 20 mg дневно при пациенти, приемащи едновременно амлодипин.
Ломитапид: рискът от миопатия и рабдомиолиза може да се увеличи при едновременното приложение на ломитапид със симвастатин (вж. точки 4.3 и 4.4). Следователно, при пациенти с хомозиготен IF, дозата INEGY не трябва да надвишава 10 mg / 40 mg на ден при пациенти, получаващи едновременно лечение с ломитапид.
Умерени инхибитори на CYP3A4: Пациентите, приемащи други лекарствени продукти, за които е известно, че имат умерен инхибиторен ефект върху CYP3A4, когато се използват едновременно с INEGY, особено с по -високи дози INEGY, могат да имат повишен риск от миопатия (вж. Точка 4.4).
Инхибитори на транспортния протеин OATP1B1: симвастатиновата киселина е субстрат на транспортния протеин OATP1B1. Едновременното приложение на лекарствени продукти, които са инхибитори на транспортния протеин OATP1B1, може да доведе до повишаване на плазмените концентрации на симвастатинова киселина и повишен риск от миопатия (вж. Точки 4.3 и 4.4).
Грейпфрутов сок: сокът от грейпфрут инхибира цитохром Р450 3А4. Едновременният прием на симвастатин и големи количества (повече от един литър на ден) сок от грейпфрут доведоха до 7-кратно увеличаване на експозицията на симвастатинова киселина. Приемът на 240 мл сок от грейпфрут сутрин и симвастатин вечер също води до 1,9-кратно увеличение, поради което приемът на грейпфрутов сок по време на лечението с INEGY трябва да се избягва.
Колхицин: Има съобщения за миопатия и рабдомиолиза при едновременното приложение на колхицин и симвастатин при пациенти с бъбречно увреждане. Препоръчва се внимателно клинично наблюдение на такива пациенти, приемащи тази комбинация.
Рифампицин: тъй като рифампицин е мощен индуктор на CYP3A4, пациентите, подложени на продължителна терапия с рифампицин (напр. лечение на туберкулоза), могат да получат загуба на ефикасност на симвастатин. Във фармакокинетично проучване при здрави доброволци, площта под кривата на плазмената концентрация (AUC) за симвастатинова киселина се намалява с 93% при едновременно приложение на рифампицин.
Ниацин: Наблюдавани са случаи на миопатия / рабдомиолиза при едновременно приложение на симвастатин с модифициращи липидите дози ниацин (≥ 1 g / ден) (вж. Точка 4.4).
Ефекти на INEGY върху фармакокинетиката на други лекарствени продукти
Езетимиб
В предклинични проучвания е езетимиб не е индуцирал ензими на цитохром Р450, участващи в метаболизма на лекарството. Не са наблюдавани клинично значими фармакокинетични взаимодействия между езетимиб и лекарства, подложени на метаболизъм от цитохроми Р450 1A2, 2D6. 2C8, 2C9 и 3A4 или N- ацетилтрансфераза.
Антикоагуланти: в проучване при дванадесет здрави възрастни мъже, едновременното приложение на езетимиб (10 mg веднъж дневно) няма значителен ефект върху бионаличността на варфарин и протромбиновото време. Има постмаркетингови съобщения за увеличаване на международното нормализирано съотношение при пациенти, които са добавили езетимиб към варфарин или флуиндион. вижте точка 4.4).
Симвастатин: симвастатин няма инхибиращ ефект върху цитохром Р450 3А4. Следователно не се очаква действие на симвастатин върху плазмените концентрации на вещества, метаболизирани чрез цитохром Р450 3А4.
Перорални антикоагуланти: в две клинични проучвания, едното при нормални доброволци, а другото при пациенти с хиперхолестеролемия, симвастатин 20-40 mg / ден умерено потенцира ефекта на кумариновите антикоагуланти; протромбиновото време, отчетено като Международно нормализирано съотношение (INR), се е увеличило от изходното ниво от 1,7 до 1,8 и от изходното ниво от 2,6 до 3,4 съответно при доброволците и изследваните пациенти. Съобщавани са много редки случаи на повишен INR. При пациенти, лекувани с кумаринови антикоагуланти, протромбиновото време трябва да бъде определено преди започване на лечението с INEGY и достатъчно често през ранните етапи на терапията, за да се гарантира, че няма да настъпи значителна промяна на протромбиновото време. След като бъде документирано стабилно протромбиново време, протромбиновото време може да бъде проследено на интервалите, рутинно препоръчани за пациенти на кумаринови антикоагуланти. Ако дозата на INEGY се промени или приложението се прекъсне, същата процедура трябва да се повтори. Терапията със симвастатин не е свързана с кървене или промени в протромбиновото време при пациенти, които не са на антикоагулантна терапия.
Педиатрична популация
Проучвания за взаимодействия са провеждани само при възрастни.
04.6 Бременност и кърмене
Бременност
Атеросклерозата е хроничен процес и рутинното преустановяване на лекарствата за понижаване на липидите по време на бременност трябва да има незначително въздействие върху дългосрочния риск, свързан с първичната хиперхолестеролемия.
ИНЕГИЯ
INEGY е противопоказан по време на бременност. Няма налични клинични данни за употребата на INEGY по време на бременност Проучванията при животни при комбинирана терапия показват репродуктивна токсичност (вж. Точка 5.3).
Симвастатин
Безопасността на симвастатин при бременни жени не е установена. Не са провеждани контролирани клинични проучвания със симвастатин при бременни жени. Има редки съобщения за вродени аномалии след вътрематочна експозиция на инхибитори на HMG-CoA редуктаза. Въпреки това, в проспективен анализ на приблизително 200 бременности, изложени през първия триместър на симвастатин или друг близко свързан инхибитор на HMG-CoA редуктазата, честотата на вродени аномалии е сравнима с тази, наблюдавана при общата популация. Този брой бременности е бил статистически достатъчен, за да се изключи увеличаване на вродените аномалии от 2,5 пъти или повече от изходната честота.
Въпреки че няма доказателства, че честотата на вродени аномалии в потомството на пациенти, лекувани със симвастатин или други близки сродни инхибитори на HMG-CoA редуктазата, се различава от тази, наблюдавана в общата популация, лечението на майки със симвастатин може да намали нивата на фетален мевалонат, Предшественик на биосинтеза на холестерол. Поради тази причина INEGY не трябва да се използва при жени, които са бременни, желаят да забременеят или подозират, че са бременни. че жената не е бременна (вж. точка 4.3).
Езетимиб
Няма данни от клинични изпитвания за употребата на езетимиб по време на бременност.
Време за хранене
INEGY е противопоказан по време на кърмене.Проучванията при плъхове показват, че езетимиб се екскретира в млякото. Не е известно дали активните компоненти на INEGY се екскретират в кърмата (вж. Точка 4.3).
Плодовитост
Езетимиб
Няма данни от клинични проучвания за ефектите на езетимиб върху фертилитета при хора.Езетимиб няма ефект върху фертилитета при мъжки или женски плъхове (вж. Точка 5.3).
Симвастатин
Няма налични данни от клинични проучвания за ефектите на симвастатин върху фертилитета при хора.Симвастатин няма ефект в проучванията за фертилитета при плъхове (вж. Точка 5.3).
04.7 Ефекти върху способността за шофиране и работа с машини
Не са провеждани проучвания за ефектите върху способността за шофиране и работа с машини, но при шофиране или работа с машини трябва да се има предвид, че е съобщено замайване.
04.8 Нежелани реакции
Таблица на нежеланите реакции (клинични проучвания)
Безопасността на INEGY (или на едновременното приложение на езетимиб и симвастатин, еквивалентни на INEGY) е оценена при приблизително 12 000 пациенти в клинични проучвания.
Честотите на нежеланите реакции са класифицирани, както следва: много чести (≥ 1/10), чести (≥ 1/100,
Следните нежелани реакции са наблюдавани при пациенти, лекувани с INEGY (N = 2,404) и с по -висока честота от плацебо (N = 1,340).
Следните нежелани реакции са наблюдавани при пациенти, лекувани с INEGY (N = 9,595) и с по -висока честота, отколкото веднъж приложени статини (N = 8,883).
Педиатрична популация
В проучване, проведено при юноши (на възраст от 10 до 17 години) с хетерозиготна фамилна хиперхолестеролемия (n = 248), повишаване на ALT и / или AST (≥ 3 X ULN, последователно) се наблюдава при 3% (4 пациенти) от пациенти в групата на езетимиб / симвастатин срещу 2% (2 пациенти) от пациентите в групата на монотерапия със симвастатин; процентите за повишаване на стойностите на CPK (≥10 X ULN) са съответно 2% (2 пациенти) и 0%. Не са регистрирани случаи на миопатия.
Това проучване не е подходящо за сравняване на редки нежелани лекарствени реакции.
Пациенти с хронично бъбречно заболяване
В проучването за защита на сърцето и бъбреците (SHARP) (вж. Точка 5.1), включващо над 9 000 пациенти, лекувани с INEGY 10 mg / 20 mg дневно (n = 4,650) или плацебо (n = 4,620), профилите на безопасност, по които са били сравними среден период на проследяване от 4,9 години. В това проучване са регистрирани само сериозни нежелани събития и прекъсвания поради всяко нежелано събитие. Степента на прекратяване поради нежелани събития е сравнима (10,4% при пациенти, лекувани с INEGY, 9,8% при пациенти, лекувани с плацебо). Честотата на миопатия / рабдомиолиза е 0,2% при пациенти, лекувани с INEGY и 0,1% при пациенти, лекувани с плацебо. Последователно повишаване на трансаминазите (> 3x ULN) се наблюдава при 0,7% от пациентите, лекувани с INEGY в сравнение с 0,6% от пациентите, лекувани с плацебо.В това проучване няма статистически значимо увеличение на честотата на предварително определени нежелани събития, включително рак (9,4% за INEGY, 9,5% за плацебо), хепатит, холецистектомия или усложнения от камъни в жлъчката или панкреатит.
Лабораторни стойности
При проучвания за комбинирано дозиране честотата на клинично значимите повишения на серумните трансаминази (ALT и / или AST ≥ 3 X ULN, последователни стойности) е 1,7% при пациенти, лекувани с INEGY. Тези повишения обикновено са безсимптомни. Не са свързани с холестаза и се връщат до изходното ниво след прекратяване на терапията или по време на лечението (вж. точка 4.4).
Клинично значимо увеличение на CK (≥10 X ULN) се наблюдава при 0,2% от пациентите, лекувани с INEGY.
Постмаркетингов опит
Следните допълнителни нежелани реакции са съобщени при постмаркетингова употреба с INEGY или в клинични изпитвания или по време на постмаркетингова употреба с един от отделните компоненти.
Нарушения на кръвта и лимфната система: тромбоцитопения; анемия
Нарушения на нервната система: периферна невропатия; увреждане на паметта
Дихателни, гръдни и медиастинални нарушения: кашлица; диспнея; интерстициална белодробна болест (вж. точка 4.4)
Стомашно -чревни нарушения: запек; Панкреатит; гастрит
Нарушения на кожата и подкожната тъкан: алопеция; мултиформена еритема; реакции на свръхчувствителност, включително обрив, уртикария, анафилаксия, ангиоедем
Нарушения на опорно -двигателния апарат и съединителната тъкан: мускулни крампи; миопатия * (включително миозит); рабдомиолиза със или без остра бъбречна недостатъчност (вж. точка 4.4); тендинопатия, понякога усложнена от разкъсване; имунно-медиирана некротизираща миопатия (IMNM) (неизвестна честота) **
* В клинично проучване миопатия се среща често при пациенти, лекувани със симвастатин 80 mg / ден в сравнение с пациенти, лекувани с 20 mg / ден (съответно 1,0% спрямо 0,02%) (вж. Точки 4.4 и 4.5).
** Има много редки съобщения за имунно-медиирана некротизираща миопатия (IMNM), автоимунна миопатия, по време или след лечение с някои статини.IMNM се характеризира с: персистираща проксимална мускулна слабост и повишена серумна креатинкиназа, които продължават въпреки преустановяването на лечението със статини; мускулна биопсия, показваща некротизираща миопатия без значително възпаление; подобрение с имуносупресивни средства (вж. Точка 4.4).
Нарушения на метаболизма и храненето: намален апетит
Съдови нарушения: горещи вълни; хипертония
Общи нарушения и състояния на мястото на приложение: боли
Хепатобилиарни нарушения: хепатит / жълтеница; фатална и нефатална чернодробна недостатъчност; холелитиаза; холецистит
Нарушения на репродуктивната система и гърдите: еректилна дисфункция
Психични разстройства: депресия, безсъние
Рядко се съобщава за синдром на явна свръхчувствителност, включително някои от следните: ангиоедем, лупусоподобен синдром, ревматична полимиалгия, дерматомиозит, васкулит, тромбоцитопения, еозинофилия, повишена скорост на утаяване на еритроцитите, артрит и артралгия, уртикария, фоточувствителност, треска, горещи вълни, хрипове и неразположение.
Лабораторни стойности: повишена алкална фосфатаза; анормален тест за чернодробна функция.
Съобщава се за повишаване на HbA1c и серумна глюкоза на гладно със статини, включително симвастатин.
Има редки постмаркетингови съобщения за когнитивни увреждания (напр. Загуба на памет, забравяне, амнезия, увреждане на паметта, объркване), свързани с употребата на статини, включително симвастатин. Докладите като цяло са несериозни. с различно време за поява на симптомите (1 ден до години) и разрешаване на симптомите (медиана 3 седмици).
Следните допълнителни нежелани реакции са съобщени при някои статини:
• Нарушения на съня, включително кошмари
• Сексуална дисфункция
• Захарен диабет: честотата ще зависи от наличието или отсъствието на рискови фактори (кръвна захар на гладно ≥ 5,6 mmol / L, BMI> 30 kg / m2, повишени нива на триглицериди, анамнеза за хипертония).
Докладване на предполагаеми нежелани реакции
Съобщаването на предполагаеми нежелани реакции, настъпили след разрешаване на лекарствения продукт, е важно, тъй като позволява непрекъснато проследяване на съотношението полза / риск на лекарствения продукт. От медицинските специалисти се изисква да съобщават за всякакви предполагаеми нежелани реакции чрез националната система за докладване. "Адрес: www .agenziafarmaco.gov.it/it/responsabili.
04.9 Предозиране
ИНЕГИЯ
В случай на предозиране трябва да се използват симптоматични и поддържащи мерки. Едновременното приложение на езетимиб (1 000 mg / kg) и симвастатин (1 000 mg / kg) се понася добре при проучвания за остра орална токсичност при мишки и плъхове. При тези животни не са наблюдавани клинични признаци на токсичност. Оралната оценка на LD50 за двата вида е езетимиб ≥ 1000 mg / kg / симвастатин ≥ 1000 mg / kg.
Езетимиб
В клинични проучвания прилагането на езетимиб, 50 mg / ден на 15 здрави лица в продължение на до 14 дни, или 40 mg / ден на 18 пациенти с първична хиперхолестеролемия до 56 дни, обикновено се понася добре. Съобщавани са няколко случая на предозиране; повечето от тях не са свързани със странични ефекти. Докладваните странични ефекти не са сериозни. При животни не се наблюдава токсичност след еднократни перорални дози от 5000 mg / kg езетимиб при плъхове и мишки и 3000 mg / kg при кучета.
Симвастатин
Съобщавани са няколко случая на предозиране; максималната взета доза е 3,6 g. Всички пациенти се възстановяват без последствия.
05.0 ФАРМАКОЛОГИЧНИ СВОЙСТВА
05.1 Фармакодинамични свойства
Фармакотерапевтична група: HMG-CoA редуктазни инхибитори в комбинация с други фармакологични средства, които променят липидния профил, ATC код: C10BA02
INEGY (езетимиб / симвастатин) е продукт за понижаване на липидите, който селективно инхибира чревната абсорбция на холестерол и свързаните с него растителни стероли и инхибира ендогенния синтез на холестерол.
Механизъм на действие
ИНЕГИЯ
Плазменият холестерол се получава от чревна абсорбция и ендогенен синтез.ИНЕГИЯ съдържа езетимиб и симвастатин, две липидопонижаващи съединения с допълнителни механизми на действие. INEGY намалява повишените нива на общия холестерол (общ-C), LDL-C, аполипопротеин В (Апо В), триглицериди (TG), липопротеин с висока плътност (С-не-HDL) холестерол и повишава холестерола при високи липопротеин с плътност (HDL-C) чрез двойното инхибиране на абсорбцията и синтеза на холестерол.
Езетимиб
Езетимиб инхибира чревната абсорбция на холестерол. Езетимиб е орално активен и има механизъм на действие, който се различава от този на други класове понижаващи холестерола вещества (напр. Статини, секвестранти на жлъчните киселини [смоли], производни на фибринова киселина и растителни станоли). Молекулната цел на езетимиб е транспортиращият стерол , Niemann-Pick C1-Like 1 (NPC1L1), отговорен за чревното усвояване на холестерол и фитостероли.
Езетимиб се локализира на нивото на границата на четката на тънките черва и инхибира абсорбцията на холестерол, причинявайки намаляване на преминаването на чревния холестерол към черния дроб; статините намаляват синтеза на холестерол в черния дроб и тези два отделни механизма предизвикват допълнително намаляване на холестерола. В двуседмично клинично проучване на 18 пациенти с хиперхолестеролемия, езетимиб инхибира чревната абсорбция на холестерол с 54% в сравнение с плацебо.
Бяха проведени редица предклинични проучвания за определяне на селективността на езетимиб при инхибиране на абсорбцията на холестерол.Езетимиб инхибира абсорбцията на [14С] -холестерол без ефект върху абсорбцията на триглицериди, мастни киселини, жлъчни киселини, прогестерон, етинил естрадиол, или мастноразтворими витамини А и D.
Симвастатин
След перорално поглъщане, симвастатин, който е неактивен лактон, се хидролизира в черния дроб в съответната активна бета-хидроксикиселинна форма, която има силно инхибиращо действие върху HMG-CoA редуктаза (3-хидрокси-3-метилглутарил CoA редуктаза). Този ензим катализира превръщането на HMG-CoA в мевалонат, ранен и ограничаващ етап в биосинтеза на холестерола.
Доказано е, че симвастатин намалява както нормалните, така и повишените концентрации на LDL-C. LDL се образува от липопротеин с много ниска плътност (VLDL) и се катаболизира главно от LDL рецептора с висок афинитет. C-VLDL) и индуцирането на LDL рецептора, което води до намаляване на производството и увеличаване на LDL-C катаболизма. Аполипопротеин В също намалява значително по време на лечението със симвастатин. Симвастатин също умерено повишава HDL-C и намалява плазмения TG. В резултат на тези промени съотношенията между общия холестерол / HDL-C и LDL-C / C-HDL се намаляват.
Клинична ефикасност и безопасност
В контролирани клинични проучвания INEGY значително намалява общия C, LDL-C, Apo B, TG и не-HDL-C и повишава HDL-C при пациенти с хиперхолестеролемия.
Първична хиперхолестеролемия
В 8-седмично, двойно-сляпо, плацебо-контролирано проучване, 240 пациенти с хиперхолестеролемия, които вече са били на монотерапия със симвастатин и които не са постигнали целта за LDL-C съгласно Националната образователна програма за холестерол (NCEP) (от 2, 6 до 4,1 mmol / l [100 до 160 mg / dl в зависимост от изходните характеристики) бяха рандомизирани да получават 10 mg езетимиб или плацебо в допълнение към тяхната съществуваща терапия със симвастатин. не бяха достигнали изходната цел на LDL-C (~ 80%), значително повече пациенти, рандомизирани на езетимиб, прилагани със симвастатин, постигат целта за LDL-C в крайната точка на проучването, в сравнение с пациенти, рандомизирани на плацебо, прилагани едновременно със симвастатин, съответно 76% и 21,5%.
Съответните намаления на LDL-C за езетимиб или плацебо, прилагани едновременно със симвастатин, са значително различни (съответно 27% и 3%).
Освен това, езетимиб, прилаган едновременно със симвастатин, значително намалява общия C, Apo B, TG в сравнение с плацебо, прилаган едновременно със симвастатин.
В 24-седмично двойно-сляпо многоцентрово проучване 214 пациенти със захарен диабет тип 2, лекувани с тиазолидиндиони (розиглитазон и пиоглитазон) за минимум 3 месеца и симвастатин 20 mg за минимум 6 седмици със среден LDL-C 2,4 mmol / l (93 mg / dl), бяха рандомизирани да получават или 40 mg симвастатин, или едновременно приложение на активни вещества, еквивалентни на INEGY 10 mg / 20 mg. INEGY 10 mg / 20 mg е значително по-ефективен от удвояването на дозата симвастатин до 40 mg за по-нататъшно намаляване на LDL-C (-21% и 0% съответно), общия C (-14% и -1% съответно), ApoB (-14% и -2% съответно) и С-не-HDL (съответно -20% и -2%) над намаленията, наблюдавани при 20 mg симвастатин. Резултатите за HDL-C и TG между двете лечебните групи не се различават значително и резултатите не се влияят от вида на лечението с тиазолидиндиони.
Ефикасността на различните концентрации на INEGY (10 mg / 10 mg до 10 mg / 80 mg / ден) е доказана в 12-седмично, двойно-сляпо, плацебо-контролирано, многоцентрово проучване, което включва всички налични дози. всички свързани силни страни на симвастатин.
При сравняване на пациенти, лекувани с всички дози INEGY, с пациенти, лекувани с всички дози симвастатин, INEGY значително намалява общия C, LDL-C и TG (вж. Таблица 1), а също и Apo B (-42% и -29%, съответно) , не-HDL-C (съответно -49% и -34%) и С-реактивен протеин (съответно -33% и -9%). Ефектите на INEGY върху HDL-C са подобни на ефектите, наблюдавани при симвастатин. По-нататъшен анализ показа, че INEGY значително повишава HDL-C в сравнение с плацебо.
маса 1
Отговор на INEGY при пациенти с първична хиперхолестеролемия (средна промянаa% от изходното ниво при липса на лечениеb)
a За триглицериди, средно% отклонение от изходното ниво
b Базално - не при медикаментозно лечение за понижаване на липидите
c Комбинираните дози INEGY (10 / 10-10 / 80) значително намаляват общия C, LDL-C и TG в сравнение със симвастатин и значително повишават HDL-C в сравнение с плацебо.
В подобно проектирано проучване резултатите за всички липидни параметри като цяло са последователни. В комбиниран анализ на тези две проучвания липидният отговор към INEGY е сходен при пациенти с нива на TG по -големи или по -малки от 200 mg / dL.
В многоцентрово, двойно-сляпо, контролирано клинично изпитване (ENHANCE) 720 пациенти с хетерозиготна фамилна хиперхолестеролемия са рандомизирани да получават 10 mg езетимиб в комбинация със 80 mg симвастатин (n = 357) или 80 mg симвастатин (n = 363) за 2 години. Основната цел на изследването е да се изследва ефекта от комбинираната терапия езетимиб / симвастатин върху дебелината на туниката на интимата и средата (IMT) на каротидната артерия в сравнение само със симвастатин. Влиянието на този маркер все още не е доказано. за сърдечно -съдова заболеваемост и смъртност.
Първичната крайна точка, средната промяна на IMT на всичките шест каротидни сегмента, не се различава значително (р = 0,29) между двете групи на лечение въз основа на ултразвукови измервания във В-режим. При езетимиб 10 mg в комбинация със симвастатин 80 mg или симвастатин 80 mg самостоятелно, дебелината на интимата и медиалната туника се увеличава съответно с 0,0111 mm и 0,0058 mm през продължителността на 2-годишното проучване (в изходното ниво средното каротидно измерване на IMT е 0,68 мм и 0,69 мм съответно).
Езетимиб 10 mg в комбинация със 80 mg симвастатин намалява LDL-C, общия C, Apo B и TG значително повече от 80 mg симвастатин.За двете групи на лечение процентното увеличение на C-HDL е подобно. Нежеланите реакции, съобщени при езетимиб 10 mg в комбинация със симвастатин 80 mg, съответстват на известния му профил на безопасност.
INEGY съдържа симвастатин. В две големи плацебо-контролирани клинични изпитвания, Скандинавско проучване за оцеляване на симвастатин (20-40 mg n = 4 444 пациенти) e Проучване за защита на сърцето (40 mg; N = 20 536 пациенти), ефектът от терапията със симвастатин е оценен при пациенти с висок риск от коронарни инциденти, дължащи се на продължаваща коронарна болест на сърцето, диабет, периферно съдово заболяване, анамнеза за инсулт или друго мозъчно -съдово заболяване. Лечението със симвастатин има е доказано, че намалява: риска от обща смъртност чрез намаляване на смъртните случаи вследствие на ИБС; риска от нефатален инфаркт на миокарда и инсулт; и необходимостта от операция с коронарни и некоронарни реваскуларизационни процедури.
Проучването на ефективността на допълнителните намаления на холестерола и хомоцистеина (SEARCH) оценява ефекта от лечението със симвастатин 80 mg спрямо 20 mg (средно проследяване на 6,7 години) върху големите съдови събития (MVE; определено като фатална исхемична болест на сърцето) заболяване, нефатален миокарден инфаркт, коронарна реваскуларизационна процедура, нефатален или фатален инсулт или процедура на периферна реваскуларизация) при 12 064 пациенти с анамнеза за миокарден инфаркт. Няма значителна разлика в честотата на MVEs между двете групи; симвастатин 20 mg (n = 1 553; 25,7%) срещу 80 mg симвастатин (n = 1 477; 24,5%); RR 0,94, 95%CI: 0,88 до 1, 01. Абсолютната разлика в нивото на LDL-C между двете групи над ходът на изследването е 0,35 ± 0,01 mmol / L. Профилите на безопасност са сходни между двете лечебни групи, с изключение на „честотата на миопатия, която е приблизително 1,0% за пациентите, лекувани с симвастатин 80 mg в сравнение с 0,02% при пациенти, лекувани с 20 mg. Приблизително половината от тези случаи на миопатия са възникнали през първата година от лечението. Честотата на миопатия през всяка следваща година от лечението е приблизително 0,1%.
Доказано е, че INEGY намалява големите сърдечно -съдови събития при пациенти с хронично бъбречно заболяване; обаче не е окончателно установено увеличение на ползата от INEGY за сърдечносъдовата заболеваемост и смъртност в сравнение с тази, демонстрирана за симвастатин.
Педиатрична популация
В едно многоцентрово, двойно-сляпо, контролирано проучване, 142 момчета (етап на Танер II и по-високи) и 106 постменарче момичета, на възраст от 10 до 17 години (средна възраст 14,2 години) с хетерозиготна фамилна хиперхолестеролемия (IF хетерозиготна) с изходен LDL-C стойности, вариращи от 4,1 до 10,4 mmol / l, бяха рандомизирани за езетимиб 10 mg, прилаган едновременно със симвастатин (10, 20 или 40 mg) или симвастатин (10, 20 или 40 mg) самостоятелно за 6 седмици, езетимиб и симвастатин 40 mg едновременно прилагани или симвастатин 40 mg самостоятелно през следващите 27 седмици, а след това езетимиб и симвастатин (10 mg, 20 mg или 40 mg) едновременно прилагани с отворен етикет в продължение на 20 седмици.
На 6-та седмица езетимиб, прилаган едновременно със симвастатин (всички дози), значително намалява общия C (38% срещу 26%), LDL-C (49% срещу 34%), Apo B (39% срещу 27%) и не HDL-C (47% срещу 33%) в сравнение само със симвастатин (всички дози). Резултатите са сходни между двете групи за лечение на TG и HDL-C (-17% срещу -12% и +7% срещу +6%, На седмица 33 резултатите бяха в съответствие с тези от седмица 6 и значително повече пациенти на езетимиб и симвастатин 40 mg (62%) постигнаха „идеална терапевтична цел според NCEP AAP (
Безопасността и ефикасността на езетимиб, прилаган едновременно с дози симвастатин, по-големи от 40 mg дневно, не са проучвани при педиатрични пациенти на възраст от 10 до 17 години. Ефикасността не е проучена при пациенти на възраст под 17 години. Дългосрочна терапия с езетимиб за намаляване на заболеваемостта и смъртността в зряла възраст.
Европейската агенция по лекарствата се отказа от задължението да представи резултатите от проучванията с INEGY във всички подгрупи на педиатричната популация при хиперхолестеролемия (вж. Точка 4.2 за информация относно педиатричната употреба).
Хомозиготна семейна хиперхолестеролемия (хомозиготна IF)
Проведено е 12-седмично, рандомизирано, двойно-сляпо проучване при пациенти с клинична и / или генотипна диагноза хомозиготен IF. Бяха анализирани данни от подгрупа пациенти (n = 14), лекувани със симвастатин 40 mg в началото. Увеличаването на дозата на симвастатин от 40 на 80 mg (n = 5) доведе до 13% намаление на LDL-C спрямо изходното ниво в сравнение с 40 mg симвастатин. Едновременното приложение на езетимиб и симвастатин, еквивалентни на INEGY (10 mg / 40 mg и 10 mg / 80 mg комбинирано, n = 9) доведе до 23% намаление на LDL-C от изходното ниво в сравнение със симвастатин 40 mg.При пациенти, прилагани едновременно с езетимиб и симвастатин, еквивалентни на INEGY (10 mg / 80 mg mg, n = 5) е постигнато намаление на LDL-C с 29% спрямо изходното ниво в сравнение със симвастатин 40 mg.
Предотвратяване на големи съдови събития при хронично бъбречно заболяване (ХБН)
Проучването за защита на сърцето и бъбреците (SHARP) е многонационално, рандомизирано, плацебо-контролирано, двойно-сляпо проучване на 9 438 пациенти с хронично бъбречно заболяване, една трета от които са били на диализа в началото. Общо 4650 пациенти са назначени на INEGY 10/20 и 4620 на плацебо и са проследени в продължение на медиана от 4,9 години. Пациентите са на средна възраст от 62 години и 63% са мъже, 72% бели, 23% диабетици, а за тези, които не са на диализа, средната прогнозна скорост на гломерулна филтрация (eGFR) е 26,5 ml / min. / 1,73 m2. няма критерий за включване в липидно проучване. Средният изходен LDL-C е 108 mg / dL. След една година, включително пациенти, които вече не приемат изследваното лекарство, LDL-C е намален с 26% в сравнение с плацебо само от 20 mg симвастатин и от 38% от INEGY 10 mg / 20 mg.
Първичното сравнение, посочено в протокола SHARP, е „анализ на намерението за лечение на„ големи съдови събития “(MVE; дефиниран като нефатален миокарден инфаркт или сърдечна смърт, инсулт или каквато и да е реваскуларизационна процедура) само при тези пациенти, първоначално рандомизирани към INEGY (n = 4,193) или плацебо (n = 4,191) групи. Вторичните анализи включват същия състав, анализиран за цялата рандомизирана кохорта (изходно ниво на изследването или 1 година) до INEGY (n = 4,650) или плацебо (n = 4,620) като както и компонентите на този композит.
Анализът на първичната крайна точка показа, че INEGY значително намалява риска от големи съдови събития (749 пациенти със събития в групата на плацебо срещу 639 в групата INEGY) с относително намаляване на риска от 16% (р = 0,001).
Дизайнът на това проучване обаче не позволява отделен принос на монокомпонентния езетимиб за ефикасността за значително намаляване на риска от големи съдови събития при пациенти с ХБН.
Отделните компоненти на MVE при всички рандомизирани пациенти са показани в Таблица 2. INEGY значително намалява риска от инсулт и всякаква реваскуларизация, без значителни числени различия, благоприятстващи INEGY за нефатален миокарден инфаркт и сърдечна смърт.
Таблица 2
Основни съдови събития по лечебна група при всички рандомизирани пациенти в SHARPa
a Анализ по намерение да се лекуват всички пациенти с SHARP, рандомизирани на INEGY или плацебо в началото или 1 година
b MAE; дефиниран като състав на нефатален миокарден инфаркт, коронарна смърт, нехеморагичен инсулт или всякаква реваскуларизация
Абсолютното намаление на LDL холестерола, постигнато с INEGY, е по-ниско при пациенти с по-нисък изходен LDL-C (
Аортна стеноза
Симвастатин и Езетимиб за лечение на аортна стеноза (SEAS) са многоцентрово, двойно-сляпо, плацебо-контролирано проучване със средна продължителност от 4,4 години при 1873 пациенти с асимптоматична аортна стеноза (АС), документирано от пиковия аортен поток, измерен чрез Доплер между 2,5 и 4,0 m / s. Включени са само пациенти, за които лечението със статини не се счита за необходимо, за да се намали рискът от атеросклеротично сърдечно -съдово заболяване. Пациентите са рандомизирани в съотношение 1: 1, за да получават плацебо или езетимиб 10 mg и симвастатин 40 mg дневно при едновременно приложение.
Първичната крайна точка е съставена от основни сърдечно-съдови събития (MCE), състоящи се от сърдечно-съдова смърт, хирургична подмяна на аортна клапа (AVR), застойна сърдечна недостатъчност (CHF) в резултат на прогресия на AS, нефатален инфаркт на миокарда, байпас на коронарната артерия (CABG )), перкутанна коронарна интервенция (PCI), хоспитализация за нестабилна стенокардия и нехеморагичен инсулт. Ключовите вторични крайни точки са съставни подмножества от категориите събития на първичната крайна точка.
В сравнение с плацебо, езетимиб / симвастатин 10 mg / 40 mg не намалява значително риска от MCE. Първичният резултат е настъпил при 333 пациенти (35,3%) в групата на езетимиб / симвастатин и при 355 пациенти (38,2%) в групата на плацебо (съотношение на риска в групата на езетимиб / симвастатин, 0,96; доверителен интервал 95%, 0,83 до 1,12; p = 0,59) Подмяната на аортната клапа е извършена при 267 пациенти (28,3%) в групата на езетимиб / симвастатин и при 278 пациенти (29,9%) в групата на плацебо (съотношение на опасност, 1,00; 95%CI, 0,84 до 1,18; p = 0,97).По -малко пациенти са имали исхемични сърдечно -съдови събития в групата на езетимиб / симвастатин (n = 148), отколкото в групата на плацебо (n = 187) (съотношение на опасност, 0,78; 95% CI, 0,63 до 0,97; р = 0,02), главно поради по -малък брой пациенти, претърпели коронарен байпас.
Ракът се среща по -често в групата на езетимиб / симвастатин (105 срещу 70, р = 0,01). Клиничната значимост на това наблюдение е несигурна, тъй като в по -голямото проучване SHARP общият брой пациенти с какъвто и да е вид инцидентен рак (438 в групата на езетимиб / симвастатин спрямо 439 в групата на плацебо) не е различен и следователно резултатът от SEAS проучване не може да бъде потвърдено от SHARP.
05.2 Фармакокинетични свойства
Не се наблюдават значителни фармакокинетични взаимодействия по време на едновременното приложение на езетимиб и симвастатин.
Абсорбция
ИНЕГИЯ
INEGY е биоеквивалентен на едновременното приложение на езетимиб и симвастатин.
Езетимиб
След перорално приложение езетимиб се абсорбира бързо и обширно с фармакологично активния фенолен глюкуронид (езетимиб-глюкуронид). Средните пикови плазмени концентрации (Cmax) се наблюдават в рамките на 1-2 часа за езетимиб-глюкуронид и 4 -12 часа за езетимиб. абсолютната бионаличност на езетимиб не може да бъде определена, тъй като съединението е практически неразтворимо във водна среда, подходяща за инжектиране.
Едновременното приемане на храна (ястия с високо съдържание на мазнини или без мазнини) няма ефект върху пероралната бионаличност на езетимиб, прилаган под формата на таблетки от 10 mg.
Симвастатин
Наличието на активна β-хидрокси киселина в системната циркулация след перорална доза симвастатин е по-малко от 5% от дозата, в съответствие с обширната чернодробна екстракция при първо преминаване. Основните метаболити на симвастатин, присъстващи в човешката плазма, са β-хидрокси киселина и четири други активни метаболита.
Плазмените профили както на общите, така и на активните инхибитори не се променят при приложение на симвастатин непосредствено преди стандартно хранене в сравнение с гладно.
Разпределение
Езетимиб
Езетимиб и езетимиб-глюкуронид се свързват съответно 99,7% и 88-92% с човешките плазмени протеини.
Симвастатин
И симвастатин, и β-хидрокси киселина са свързани с човешки плазмени протеини (95%).
Фармакокинетиката на симвастатин при единична и многократна доза не показва натрупване на лекарство след многократни дози. Във всички горепосочени фармакокинетични проучвания максималната концентрация на инхибитори е настъпила от 1,3 до 2,4 часа след дозата.
Биотрансформация
Езетимиб
Езетимиб се метаболизира предимно в тънките черва и черния дроб чрез глюкуронидна конюгация (реакция фаза II) с последваща жлъчна екскреция. Минимален окислителен метаболизъм (реакция фаза I) се наблюдава при всички оценени видове. Езетимиб и езетимиб глюкуронид са основните лекарствени съединения, открити в плазмата, което представлява съответно приблизително 10-20% и 80-90% от общото лекарство, присъстващо в плазмата. И езетимиб, и езетимиб-глюкуронид се елиминират бавно. От плазмата с доказателства на значителен ентерохепатален цикъл. Полуживотът на езетимиб и езетимиб-глюкуронид е приблизително 22 часа.
Симвастатин
Симвастатин е неактивен лактон, който бързо се хидролизира in vivo в съответната β-хидроксикиселина, мощен инхибитор на HMG-CoA редуктазата.Хидролизата протича главно в черния дроб; скоростта на хидролиза в човешката плазма е много бавна.
При хората симвастатин се абсорбира добре и преминава бързо екстракция при първо преминаване в черния дроб.Екстракцията в черния дроб зависи от чернодробния кръвен поток. Черният дроб е неговото основно място на действие с последващо отделяне на еквивалентни вещества в жлъчката. Следователно наличността на активното лекарство в системната циркулация е ниска.
След интравенозно приложение на метаболита на β-хидрокси киселина, средният му полуживот е 1,9 часа.
Елиминиране
Езетимиб
След перорално приложение на 14С езетимиб (20 mg) при хора, общият езетимиб представлява приблизително 93% от общата плазмена радиоактивност. Приблизително 78% и 11% от приложената радиоактивност се откриват съответно в изпражненията и урината за 10-дневен период на събиране на проби. След 48 часа няма откриваеми нива на радиоактивност в плазмата.
Симвастатин
Симвастатиновата киселина се транспортира активно до хепатоцитите чрез носителя OATP1B1.
След прилагане на перорална доза симвастатин при хора, 13% от радиоактивността се екскретира в урината и 60% в изпражненията в рамките на 96 часа. Количеството, открито във фекалиите, представлява еквивалентните вещества, екскретирани в жлъчката, както и неабсорбираното лекарство След интравенозно приложение на метаболита на β-хидрокси киселина, само средно 0,3% от интравенозната доза се екскретира в урината като инхибитори.
Специални популации
Педиатрична популация
Абсорбцията и метаболизмът на езетимиб са сходни при деца и юноши (10 до 18 години) и възрастни. Въз основа на общия езетимиб няма фармакокинетични разлики между юноши и възрастни Фармакокинетични данни при ситостеролемия при педиатричната популация (вж. Точка 4.2).
Възрастни граждани
Плазмените концентрации на общия езетимиб са приблизително два пъти по-високи при възрастните хора (≥ 65 години), отколкото при младите (18-45 години). Намаляването на LDL-C и профилът на безопасност са сравними между възрастните и по-младите индивиди, лекувани с езетимиб (вж. Точка 4.2 ).
Чернодробно увреждане
След прилагане на единична доза от 10 mg езетимиб, средната площ под кривата (AUC) за общия езетимиб се е увеличила приблизително 1,7 пъти при пациенти с леко чернодробно увреждане (оценка по Child Pugh 5 или 6) в сравнение със здрави индивиди. В 14-дневно проучване с многократна доза (10 mg / ден) при пациенти с умерено чернодробно увреждане (Child Pugh оценка 7 до 9) средната AUC за общия езетимиб се увеличава приблизително 4 пъти на ден 1 и на 14-ия ден в сравнение със здрави индивиди. Не е необходимо коригиране на дозата при пациенти с леко чернодробно увреждане. Поради неизвестните ефекти от повишената експозиция на езетимиб при пациенти с умерено или тежко чернодробно увреждане (оценка по Child Pugh> 9), езетимиб не се препоръчва при тези пациенти (вж. Точки 4.2. И 4.4).
Увреждане на бъбреците
Езетимиб
След еднократна доза от 10 mg езетимиб при пациенти с тежко бъбречно увреждане (n = 8; среден CrCl ≤30 ml / min), средната AUC за общия езетимиб се увеличава приблизително 1,5 пъти в сравнение със здрави индивиди. (N = 9), (вж. точка 4.2).
Допълнителен пациент в това проучване (след бъбречна трансплантация и лекуван с многократна медикаментозна терапия, включително циклоспорин) е имал 12-кратна "експозиция на" общ езетимиб.
Симвастатин
В проучване с пациенти с тежко бъбречно увреждане (креатининов клирънс
Секс
Плазмените концентрации на общия езетимиб са малко по-високи (приблизително 20%) при жените, отколкото при мъжете. Намаляването на LDL-C и профилът на безопасност са сравними между мъжете и жените, лекувани с езетимиб.
SLCO1B1 полиморфизъм
Носителите на алела c.521T> C на гена SLCO1B1 са намалили активността на OATP1B1. Средната експозиция (AUC) на основния активен метаболит, симвастатинова киселина, е 120% при хетерозиготни носители на алела С (CT) и 221% в хомозиготи (CC) в сравнение с тези на пациентите с най -често срещан генотип (TT) .Алелът C има честота 18% в европейската популация. Съществува риск от повишена експозиция на симвастатинова киселина при пациенти с полиморфизъм на SLCO1B1, което може да доведе до повишен риск от рабдомиолиза (вж. Точка 4.4).
05.3 Предклинични данни за безопасност
ИНЕГИЯ
При проучвания за едновременно приложение с езетимиб и симвастатин наблюдаваните токсични ефекти са по същество тези, които обикновено са свързани със статини. Някои от токсичните ефекти са по -изразени от тези, наблюдавани само при лечение със статини. Това се дължи на фармакокинетични и / или фармакодинамични взаимодействия при едновременното приложение. В клинични проучвания не се наблюдават подобни взаимодействия. Епизоди на миопатия се появяват при плъхове само след експозиция на дози, няколко пъти по -високи от терапевтичната доза при хора (приблизително 20 пъти нивото на AUC за симвастатин и 1800 пъти нивото на AUC за активния метаболит). Няма доказателства, че едновременното приложение на езетимиб е повлияло върху миотоксичния потенциал на симвастатин.
При кучета, прилагани едновременно с езетимиб и статини, при ниска експозиция (хиперплазия на жлъчните пътища, натрупване на пигменти, мононуклеарна клетъчна инфилтрация и малки хепатоцити). Тези промени не се развиват при излагане на продължителни дози до 14 месеца. Наблюдава се цялостно възстановяване на резултатите от чернодробните тестове след преустановяване на експозицията. Тези данни са в съответствие с тези, описани с инхибитори на HMG-CoA, или се дължат на много ниските нива на холестерол, постигнати при изследваните кучета.
Едновременното приложение на езетимиб и симвастатин не е тератогенно при плъхове. При бременни женски зайци са наблюдавани ограничен брой скелетни деформации (сливане на опашните прешлени, намален брой на опашните прешлени).
В поредица от есета in vivo И инвитро Езетимиб, прилаган самостоятелно или едновременно прилаган със симвастатин, не показва генотоксичен потенциал.
Езетимиб
Проучванията при животни с хронична токсичност с езетимиб не идентифицират целевите органи за токсични ефекти. При кучета, лекувани в продължение на 4 седмици с езетимиб (≥ 0,03 mg / kg / ден), концентрацията на холестерол в жлъчката се увеличава с 2,5 до 3,5 пъти. Въпреки това не се наблюдава повишена честота на холелитиаза или други хепатобилиарни ефекти при едногодишно проучване с кучета, лекувано с дози до 300 mg / kg / ден. Клиничната стойност на тези данни за хора е неизвестна. Не може да се изключи риск от литогенеза, свързан с терапевтичната употреба на езетимиб.
Дългосрочните тестове за канцерогенност на езетимиб са отрицателни.
Езетимиб няма ефект върху фертилитета при двата пола при плъхове, не е открита тератогенност при плъхове или зайци, нито е променено пред- или постнаталното развитие. Езетимиб преминава през плацентарната бариера при женски плъхове. кг / ден.
Симвастатин
Въз основа на конвенционални фармакодинамични проучвания върху животни, токсичност при многократни дози, генотоксичност и канцерогенеза, няма други рискове за пациента, освен очакваните въз основа на фармакологичния механизъм. При максимално поносими дози както при плъхове, така и при зайци, симвастатин не води до малформации на плода и няма ефект върху фертилитета, репродуктивната функция или развитието на новороденото.
06.0 ФАРМАЦЕВТИЧНА ИНФОРМАЦИЯ
06.1 Помощни вещества
Бутилхидроксианизол
Лимонена киселина монохидрат
Натриева кроскармелоза
Хипромелоза
Лактоза монохидрат
Магнезиев стеарат
Микрокристална целулоза
Пропилалат
06.2 Несъвместимост
Не е от значение.
06.3 Срок на валидност
2 години.
06.4 Специални условия на съхранение
Да не се съхранява над 30 ° C.
Блистери: Съхранявайте в оригиналната опаковка, за да предпазите лекарството от светлина и влага.
Бутилки: Съхранявайте бутилката плътно затворена, за да предпазите лекарството от светлина и влага.
06.5 Естество на непосредствената опаковка и съдържанието на опаковката
INEGY 10 mg / 10 mg, 10 mg / 20 mg и 10 mg / 40 mg
Бяла бутилка от полиетилен с висока плътност (HDPE) със защитена от деца полипропиленова капачка и изсушаващ силициев гел, запечатана със специален разтвор, съдържащ 100 таблетки.
INEGY 10 mg / 10 mg
PVC / алуминиев полиамиден блистер, заварен към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.
Еднодозов блистер от PVC / алуминиев полиамид, заварен към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.Опаковки от 30, 50, 100 или 300 таблетки.
INEGY 10 mg / 20 mg, 10 mg / 40 mg
Непрозрачен блистер от полихлоротрифлуороетилен / PVC, запечатан към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.Опаковка от 90 таблетки.
INEGY 10 mg / 20 mg, 10 mg / 40 mg и 10 mg / 80 mg
Непрозрачен блистер от полихлоротрифлуороетилен / PVC, запечатан към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.Опаковки от 7, 10, 14, 28, 30, 50, 56, 84, 98, 100 или 300 таблетки.
Еднодозов полихлоротрифлуороетилен / PVC блистер, запечатан към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.Опаковки от 30, 50, 100 или 300 таблетки.
INEGY 10 mg / 40 mg и 10 mg / 80 mg
Непрозрачен полихлоротрифлуороетилен / PVC блистер, запечатан към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.
Еднодозов блистер от полихлоротрифлуороетилен / PVC, запечатан към алуминиево фолио с помощта на винилова смола. Таблетките могат да бъдат извлечени чрез натискане върху пластмасовия джоб.Опаковки от 30, 50, 100 или 300 таблетки.
Не всички опаковки могат да бъдат пуснати на пазара.
06.6 Инструкции за употреба и боравене
Няма специални инструкции.
07.0 Притежател на разрешението за търговия
Merck Sharp & Dohme Limited
Хъртфорд Роуд,
Ходесдън, Хартфордшир
EN11 9BU Обединено кралство
08.0 НОМЕР НА РАЗРЕШЕНИЕТО ЗА ПОТРЕБЕНИЕ
100 таблетки в бутилка от 10 mg / 10 mg AIC n. 036679013
7 таблетки в блистери по 10 mg / 10 mg AIC n. 036679025
10 таблетки в блистери от 10 mg / 10 mg AIC n. 036679037
14 таблетки в блистери по 10 mg / 10 mg AIC n. 036679049
28 таблетки в блистери по 10 mg / 10 mg AIC n. 036679052
30 таблетки в блистери по 10 mg / 10 mg AIC n. 036679064
50 таблетки в блистери от 10 mg / 10 mg AIC n. 036679076
56 таблетки в блистери по 10 mg / 10 mg AIC n. 036679088
84 таблетки в блистери по 10 mg / 10 mg AIC n. 036679607
98 таблетки в блистери по 10 mg / 10 mg AIC n. 036679090
2 x 49 таблетки в 10 mg / 10 mg AIC блистери. н. 036679645
100 таблетки в блистери по 10 mg / 10 mg AIC n. 036679102
300 таблетки в блистери по 10 mg / 10 mg AIC n. 036679114
30 таблетки в блистери с еднократна доза от 10 mg / 10 mg AIC n. 036679126
50 таблетки в блистери с еднократна доза от 10 mg / 10 mg AIC n. 036679138 100 таблетки в 10 mg / 10 mg еднодозови блистери AIC n. 036679140
300 таблетки в блистери с еднократна доза от 10 mg / 10 mg AIC n. 036679153
100 таблетки в бутилка от 10 mg / 20 mg AIC n. 036679165
7 таблетки в блистери по 10 mg / 20 mg AIC n. 036679177
10 таблетки в блистери от 10 mg / 20 mg AIC n. 036679189
14 таблетки в блистери по 10 mg / 20 mg AIC n. 036679191
28 таблетки в блистери по 10 mg / 20 mg AIC n. 036679203
30 таблетки в блистери по 10 mg / 20 mg AIC n. 036679215
50 таблетки в блистери по 10 mg / 20 mg AIC n. 036679227
56 таблетки в блистери по 10 mg / 20 mg AIC n. 036679239
84 таблетки в блистери по 10 mg / 20 mg AIC n. 036679619
98 таблетки в блистери по 10 mg / 20 mg AIC n. 036679241
100 таблетки в блистери по 10 mg / 20 mg AIC n. 036679254
300 таблетки в блистери по 10 mg / 20 mg AIC n. 036679266
30 таблетки в блистери с еднократна доза от 10 mg / 20 mg AIC n. 036679278
50 таблетки в 10 mg / 20 mg еднодозови блистери AIC n. 036679280
100 таблетки в еднодозови блистери от 10 mg / 20 mg AIC n. 036679292
300 таблетки в блистери с еднократна доза от 10 mg / 20 mg AIC n. 036679304
100 таблетки в бутилка от 10 mg / 40 mg AIC n. 036679316
7 таблетки в блистери по 10 mg / 40 mg AIC n. 036679328
10 таблетки в блистери от 10 mg / 40 mg AIC n. 036679330
14 таблетки в блистери по 10 mg / 40 mg AIC n. 036679342
28 таблетки в блистери по 10 mg / 40 mg AIC n. 036679355
30 таблетки в блистери по 10 mg / 40 mg AIC n. 036679367
50 таблетки в блистери по 10 mg / 40 mg AIC n. 036679379
56 таблетки в блистери по 10 mg / 40 mg AIC n. 036679381
84 таблетки в блистери по 10 mg / 40 mg AIC n. 036679621
98 таблетки в блистери по 10 mg / 40 mg AIC n. 036679658
2x49 таблетки в 10 mg / 40 mg AIC блистери. н. 036679393
100 таблетки в блистери по 10 mg / 40 mg AIC n. 036679405
300 таблетки в блистери по 10 mg / 40 mg AIC n. 036679417
30 таблетки в блистери с еднократна доза от 10 mg / 40 mg AIC n. 036679429
50 таблетки в блистери с еднократна доза от 10 mg / 40 mg AIC n. 036679431
100 таблетки в еднодозови блистери от 10 mg / 40 mg AIC n. 036679443
300 таблетки в блистери с еднократна доза от 10 mg / 40 mg AIC n. 036679456
7 таблетки в блистери по 10 mg / 80 mg AIC n. 036679468
10 таблетки в блистери от 10 mg / 80 mg AIC n. 036679470
14 таблетки в блистери по 10 mg / 80 mg AIC n. 036679482
28 таблетки в блистери по 10 mg / 80 mg AIC n. 036679494
30 таблетки в блистери по 10 mg / 80 mg AIC n. 036679506
50 таблетки в блистери по 10 mg / 80 mg AIC n. 036679518
56 таблетки в блистери по 10 mg / 80 mg AIC n. 036679520
84 таблетки в блистери по 10 mg / 80 mg AIC n. 036679633
98 таблетки в блистери по 10 mg / 80 mg AIC n. 036679660
2 x 49 таблетки в 10 mg / 80 mg AIC блистери. н. 036679532
100 таблетки в блистери по 10 mg / 80 mg AIC n. 036679544
300 таблетки в блистери по 10 mg / 80 mg AIC n. 036679557
30 таблетки в блистери с еднократна доза от 10 mg / 80 mg AIC n. 036679569
50 таблетки в блистери с еднократна доза от 10 mg / 80 mg AIC n. 036679571
100 таблетки в еднодозови блистери от 10 mg / 80 mg AIC n. 036679583
300 таблетки в блистери с еднократна доза от 10 mg / 80 mg AIC n. 036679595
09.0 ДАТА НА ПЪРВО РАЗРЕШЕНИЕ ИЛИ ПОДНОВЯВАНЕ НА РАЗРЕШЕНИЕТО
Дата на първо разрешаване: август 2005 г.
Последна дата на подновяване: февруари 2010 г.
10.0 ДАТА НА ПРЕГЛЕД НА ТЕКСТА
Декември 2015 г.










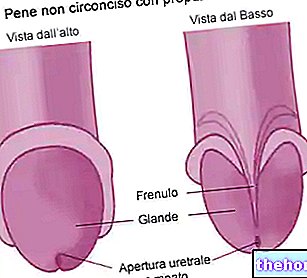











.jpg)

